 |
IX./5. fejezet: A genetikai tesztelés gyakorlati kérdései
A monogénes kórképek esetében a leggyakoribb helyzet, hogy egy ismert örökletes betegségnek megfeleltethető klinikai kép hátterében célunk a genetikai hiba azonosítása (diagnosztikus génteszt).
Mi ilyen esetben a teendő?
-
(1) Elsőként hasznos figyelembe venni az adott tünet, rendellenesség hátterében aktuálisan ismert ismereteket: milyen gének, azok milyen típusú genetikai hibái állhatnak a háttérben (több hasznos összeállítás is hozzáférhető pl. OMIM, Orphanet, NORD, Gene Reviews, Genetics Home Reference),
-
(2) Mielőtt neki látnánk ennek a sokszor hosszadalmas folyamatnak, célszerű végiggondolni, milyen eséllyel sikerülhet egyáltalán, illetve az adott teszttel a felelőssé tehető hiba azonosítása, továbbá milyen a kérdéses betegség prevalenciája. Célzott vizsgálatok esetében kezdjük mindig a leggyakoribb betegséggel (vagy lókusz heterogenitás esetén a jelentősen gyakrabban érintett génnel, illetve szűkebb genomi régióval, ha ismert a génben mutációs forrópont), és haladjunk szekvenciálisan, génről génre.
-
(3) Mielőtt elindítjuk a vizsgálatot, gondoljuk át, hogy mit is kezdhetünk a várható információval.
-
(4) A genetikai vizsgálat megválasztásakor tartsuk szem előtt a rendelkezésre álló lehetőségeket és a költséghatékonysági szempontokat is.
|

Célzott vagy átfogó genetikai tesztet válasszunk?
|
Általánosságban elmondható, hogy a genetikai diagnosztikai eljárást a fenotípus kialakításában előzetesen legvalószínűbbnek vélt genetikai eltérések vizsgálatával kezdik, és haladnak a jóval ritkább lehetőségek tesztelése felé. Fontos az egyes teszteket megelőzően annak a megfontolása, hogy milyen módszer rendelkezik a legkedvezőbb költséghatékonysági mutatókkal a pozitív eredmény várható diagnosztikai hozadékát is figyelembe véve.
|

…hogy megértsük a megfelelő első, majd a betegségokozó génhiba kimutatásának sikertelensége esetén a soron következő, genetikai teszt kiválasztásának szempontjait. A rendelkezésre álló lehetőségek optimális költség-haszon aránya az egyén, a család és a közösség szintjén is mérlegelhető.
|
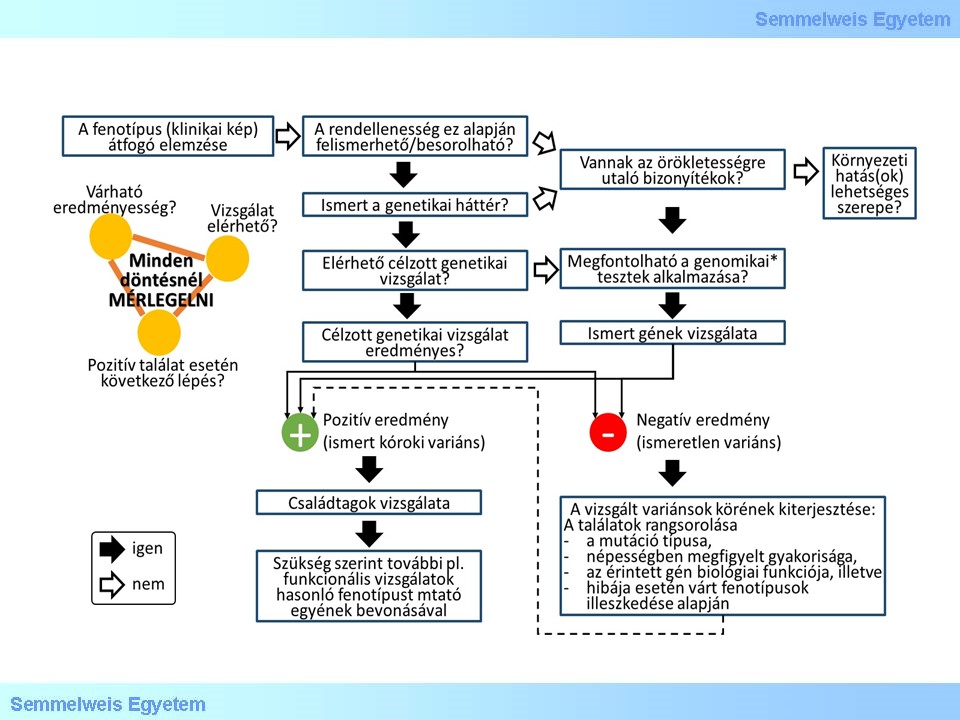
12. ábra: Általános tesztelési stratégia örökletes betegség gyanúja esetén: az omikai (genomikai*: teljes absztrakciós szinten történő mérés, pl. klinikailag releváns gének szekvenciaadatait előállító „klinikai exom”, illetve „teljes exom” vagy a közeljövőben akár „teljes genom” szekvenálás) vizsgálatok helye a vizsgálati algoritmusban
|
Mendeli öröklődésű (monogénes) genetikai betegségek hátterében álló ritka variánsok kimutatására genomikai vizsgálatot, azaz klinikai célú exom- vagy genom-szekvenálást azokban az esetekben végeznek, ha az ismert, gyakorta érintett gének célzott tesztelése nem vezetett a kóroki variáns azonosításához és a következő lépésben felmerülő, a fenotípussal asszociált génekre kiterjesztett tesztelés költsége már irracionálisan magas lenne a jelölt (kandidáns) gének nagy száma miatt.
A genetikai vizsgálatokat omikai szintre emelő újgenerációs szekvenálási technológiák megjelenése paradigmaváltást hozott a genetikai betegségek diagnosztizálásának megközelítésében. Az egyes génteszteket hagyományosan Sanger-szekvenálással végzik, amely módszer évtizedeken keresztül a molekuláris diagnózis megkerülhetetlen eszközének számított a magas analitikai érzékenysége és specificitása miatt. Az eljárás azonban nagyszámú kandidáns gén esetében rendkívül költséges és időigényes lenne. Az újgenerációs szekvenálási technológiák a masszív, párhuzamosan zajló szekvenálási reakciók eredményeképpen rendkívül nagy mennyiségű adatot képesek előállítani, a Sanger-alapú módszerekhez viszonyítva jelentősen alacsonyabb áron. A teljes exom szekvenálás (Whole-Exome Sequencing, WES) lehetővé teszi a kódoló régiók nagy részének (kb. 95%) vizsgálatát. Ez nagyságrendileg 20.000 gén exonikus variációinak egyidejű elemzését jelenti, amely jól megválasztott esetekben igen hatásos diagnosztikai módszer lehet. Exom-szekvenálással azoknak az exonokat szegélyező régiók lefedettsége is elérhető, amelyek splicingot befolyásoló kóroki variánsokat tartalmazhatnak. A teljes genom szekvenálás (Whole-Genom Sequencing, WGS) a teljes humán genom elemzésére (főként eukromatikus régióinak esetében jól teljesítő) szolgáló módszer, amely esetében mintegy 100-szor nagyobb területet fed le, aminek kiaknázása a klinikum számára várhatóan legfeljebb néhány évig várathat magára.
A ritka kórképek hátterében a genomban rejlő kóroki eltérések kiterjedése egyetlen báziscserétől egy egész kromoszóma többlete vagy hiányáig terjedően, igen eltérő lehet, amely a kimutatásukhoz alkalmazható módszert is meghatározza. A biológiai minta kiválasztása az esetek többségében egyszerűbb feladat, ám néhány speciális esetet meg kell említenünk.
|

Milyen biológiai minta a alkalmasabb a genetikai vizsgálatainkhoz?
|
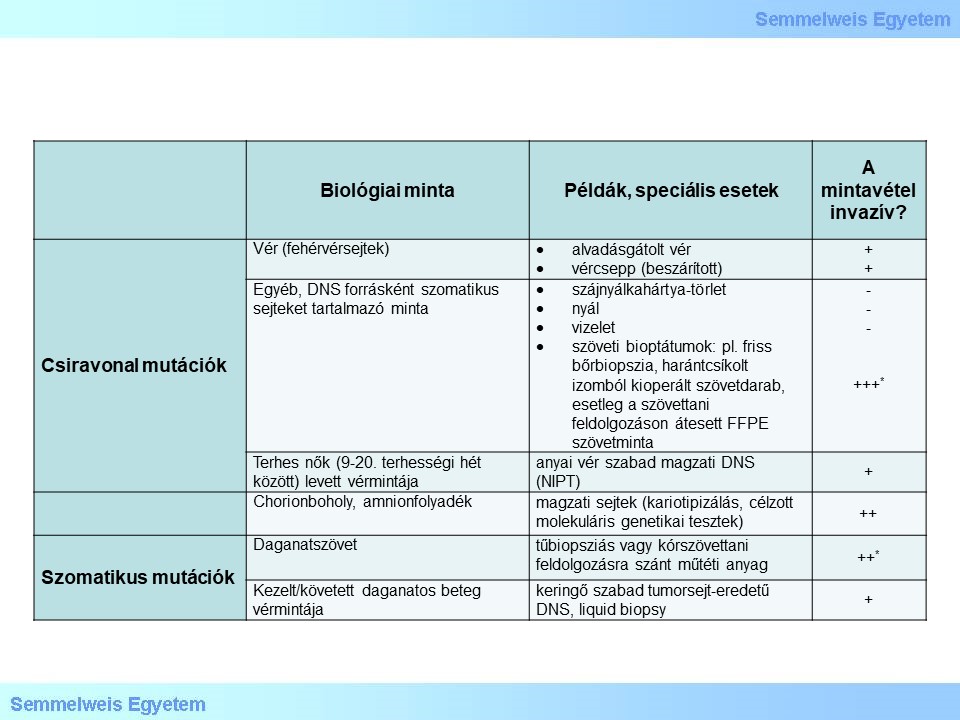
4. táblázat: Lehetséges a genetikai tesztelési gyakorlatban előforduló biológiai minták és a megszerzésükhöz vállalt invazivitás mértéke. (*egyidejűleg rendszerint szövettani és/vagy biokémiai vizsgálat is történik)
|
|
|