
driver mutációk:
jelenléte közvetett, vagy közvetlen szelektív növekedési előnyt jelent annak a sejtnek, amelyben kialakult (tehát elősegíti a tumor kifejlődését) és/vagy szignifikáns diagnosztikai és terápiás jelentősséggel bír.
|
VI./3. fejezet: Nem örökletes tumor szindrómák, gyakori tumorok
Bevezetés
A következőben legyakoribb tumorok esetén foglaljuk össze, melyek azok a genetikai eltérések, driver mutációk, melyeknek már napjainkban is gyakorlati jelentősége van ezért ajánlott a vizsgálatuk. Az említetteken kívül még számos génben fordulhat elő mutáció egy adott ráktípusban, illetve egy beteg esetében is.
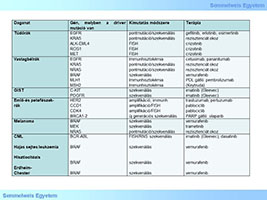
1. táblázat: Genetikai vizsgálatok tumorokban és jelentőségük
|
VI./3.1. Tüdőrák
A tüdőrák szövettanilag hagyományosan kissejtes és nem-kissejtes típusokra osztható. A nem-kissejtes tüdőrákok közül az adenocarcinomák kb. 15%-ában kb. 10 éve van lehetőség célzott génterápia alkalmazására amennyiben a driver mutáció az EGFR tirozin kináz (TK) receptorban alakul ki és nincs a célzott kezelésre rezisztenciát okozó mutáció a KRAS génben. Az KRAS fehérje több tirozin kináz receptor jelátviteli útjának a tagja, az EGFR-és más receptorok által generált jelek továbbviteléért felelős, meghibásodása esetén állandó aktiváló jelek haladnak a sejtmag felé és a TK receptor gátló gyógyszerek hatástalanná válnak. Tüdő adencarcinomák esetén a mutáns EGFR receptort gátolhatjuk kis molekulatömegű tirozin kináz inhibitorokkal (gefitinib, erlotinib). Ezen felül hazánkban körülbelül 4%-ban a ALK-EML4 transzlokáció, illetve inverzió felelős a tüdőrákért, ezekben az esetekben a crizotinib lehet a választandó gyógyszer. Kis százalékban egyéb driver mutációk okozzák a tumort, mint ROS1, MET, BRAF, illetve HER2, ezekben az esetekben szintén lehetőség lehet célzott terápiára. Ezért ma már a tüdő adenocarcinoma optimális kezeléséhez hozzátartozik a genetikai markerek vizsgálata is. Sajnos a tüdőrákok jelentős részének hátterében álló KRAS mutációkra még nem sikerült hatékony terápiát kifejleszteni.
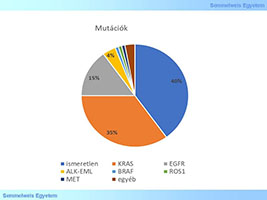
1. ábra: Tüdőrák hátterében álló mutációk
|
|
 |
VI./3.2. Vastagbélrák
A vastagbélrákok esetében számos gén mutációja ismert, mégis csak az EGFR az egyetlen széles körben elterjedt terápiás célpont. A tüdőrákokkal ellentétben itt a TK (tirozin kináz) domén mutációja igen ritka, tehát a TK gátlók hatástalanok. Ezért a célzott terápia monoklonális antitestekkel történik. A hatásmechanizmus hátterében a cetuximabnál az EGFR elleni immunreakció, a pananitumab esetében a receptor-ligand kötés gátlása áll. Érdekes módon a pananitumab esetén nem találtak összefüggést az EGFR expresszió mértéke és a szer hatása között. A szerek adásához ellenőrizni szükséges, hogy nincs-e jelen, KRAS vagy NRAS mutáció, ami a gyógyszerrel szembeni rezisztenciához vezetne. Mindkét gyógyszer hatékonysága fokozódik kemoterápiával kombinálva. Újabb eredmények alapján a BRAF mutációk is hozzájárulhatnak a rezisztencia kialakulásához, így egyre szélesebb körben igénylik vizsgálatát. Sajnos azonban a más tumorokban bevált BRAF gátlók vastagbél tumor esetében többnyire nem hatékonyak, mivel a BRAF gátlás következtében EGFR aktiváció alakul ki. A vastagbélrákok egy csoportjában a „mismatch repair” gének inaktivációja felelős a daganat kialakulásáért (pl. MLH1, MSH2), tehát a hibajavító rendszer károsodik. Ilyenkor számos genetikai hiba halmozódhat fel a daganatban, neoantigénként szolgáló kóros fehérjék termelését vonva maga után. Ezekben az esetekben az immun „check point” inhibítorok közé tartozó PD-1/PD-L1 gátlók alkalmazhatók sikerrel.
|
 |
VI./3.3. Emlőrák
Az emlőrákokban előforduló HER2 proto-onkogén amplifikációja az emlőrákok 20-30%-ban fordul elő. A gátlására hazánkban a 2001 óta alkalmazott trastuzumab (Herceptin) volt az első célzott terápia majd később megjelent a pertuzumab (Perjeta) is. Ösztrogén receptor pozitív emlőrákok esetében a ciklin dependens kinázokat (CDK4 és CDK6) gátló palbociclib alkalmazásától remélhetünk terápiás választ. A BRCA1 vagy BRCA2 hibajavító gének szerzett vagy örökletes formája által okozott emlőrák esetén a PARP gátlás adja a célzott terápia lehetőségét. Statisztikai adatok szerint a tripla negatív (ösztrogén receptor, progeszteron receptor és HER2 receptor) emlőrákokban gyakrabban találnak BRCA mutációt. Ez utóbbi esetek miatt emlőrákok esetében egyre gyakrabban kérik a BRCA1 és BRCA 2 gének szekvenálását.
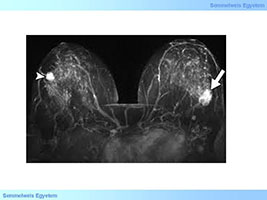
2. ábra: Bilaterális emlőrák felkelti a genetikai prediszpozíció gyanúját. (kép forrás: webdicine.com)
|
VI./3.4. Melanoma
Ebben a tumorban jelenleg a BRAF gén képezi a célzott terápia alapját, mely az esetek több mint 50%-ban driver mutáció. Jelenleg Magyarországon az elérhető készítmény a vemurafenib, a célzott terápia alkalmazáshoz a BRAF V600E vagy V600K mutáció jelenléte szükséges. A BRAF gátlókkal való kezelés során létrejöhet rezisztencia a MEK mutációja miatt, így MEK gátlóval is érdemes kiegészíteni a terápiát. A melanomák 15-25%-a NRAS mutációt hordoz. Ez a KRAS-hoz hasonlóan minden célzott terápiás lehetőséget kizár. Bár eredetileg célzott terápiának szánták őket, melanoma esetén olyan jó eredménnyel alkalmazhatóak az immun „check point” gátlók (PD-L1, PD1, CTLA4) hogy sem genetikai sem immunhisztokémiai vizsgálatra nincs szükség.
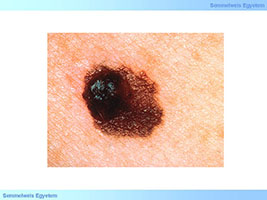
3. ábra: Melanoma (kép forrás: healthline.com)
|
|
 |
VI./3.5. Vérképző rendszeri daganatok
Ezeknél a daganatoknál jellegzetes génkárosodás a transzlokáció. A daganatok legismertebb reprezentánsa a krónikus myeloid leukaemia (CML), ahol a transzlokáció hatására egy folyamatosan aktív tirozin kináz molekula (BCR/ABL) képződik. A CML célzott kezelése igazi siker történet. A BCR-ABL fúziós tirozin kinázt gátló TK inhibitor a imatinib (Gleevec) volt az első gyógyszer, amit sikerrel alkalmaztak a daganat ellen, sok éves túlélést érve el. A gyógyszer rezisztencia kialakulása során alkalmazható új generációs gátlószereknek köszönhetően a páciens az egészséges emberek életét élheti évtizedeken át. Jóllehet a gastrointestinális stromalis tumorok nem tartoznak a hematológiai daganatok közé szintén jól reagálnak az említett Gleevec kezelésre. Ennek a daganatnak az esetén a mutáció a c-kit vagy a PDGFR tirozin kinázon alakul ki. A hajas sejtes leukémiában, a hisztiocitózisban és az Erdheim Chester betegségben BRAF mutáció fordulhat elő, ebben az esetben ezek a tumorok vemurafenibre reagálnak.
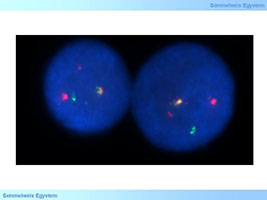
4. ábra: : BCR-ABL transzlokáczó krónikus myeloid leukémiában (piros ABL, zöld BCR, sárga: fúziós termék) (Az I.sz. Patológiai és Kísérleti Rákkutató Intézet saját anyaga)
|
|
|