
Milyen természetű genetikai eltéréseket keresünk egyáltalán egy adott szindróma vagy egy adott ritka tünet esetében?
|
IX./4. fejezet: Milyen genetikai hibákat keresünk egyáltalán?
A szindrómák, kórképek mögött álló genetikai eltérés és a lehetséges érintett gének száma nagy változatosságot mutat, ezáltal az első választott teszt is esetenként eltérő, mindig igazodva az adott szindrómák vagy kórképek diagnosztizálási lehetőségeihez.

9. ábra: A genetikai és fenotípus heterogenitás dimenziói
|
Az örökletesség gyanúját az egyes klinikai esetekben egy ritka tünet vagy tünettársulás családi halmozódása, néha jellegzetes öröklésmenet utalhat. A gyakorlatban persze a családi anamnézis bizonytalanságai mellett a genotípus-fenotípus összefüggések sokszínűsége is nehezíti ritka örökletes kórképek felfedezését és az alkalmazható vizsgálati stratégiát.

10. ábra: A genetikai és a fenotípus heterogenitásának lehetőségei
|
A genotípus-fenotípus összefüggések feltárását mendeli öröklésmenet vizsgálata esetén bizonyos jelenségek tovább nehezíthetik az említettek mellett: a de novo mutáció, a (csíravonali) mozaicizmus és a tünetek késői jelentkezése.
A kórképek genetikai hátterének azonosításában a genetikai betegség típusát, illetve a feltételezett genetikai eltérés jellegét tekintve választják meg a célravezető diagnosztikus tesztet. Emellett érdemes megfigyelni a funkcionális terméket kódoló szakaszok kiterjedése és a fenotípus komplexitása közötti összefüggést
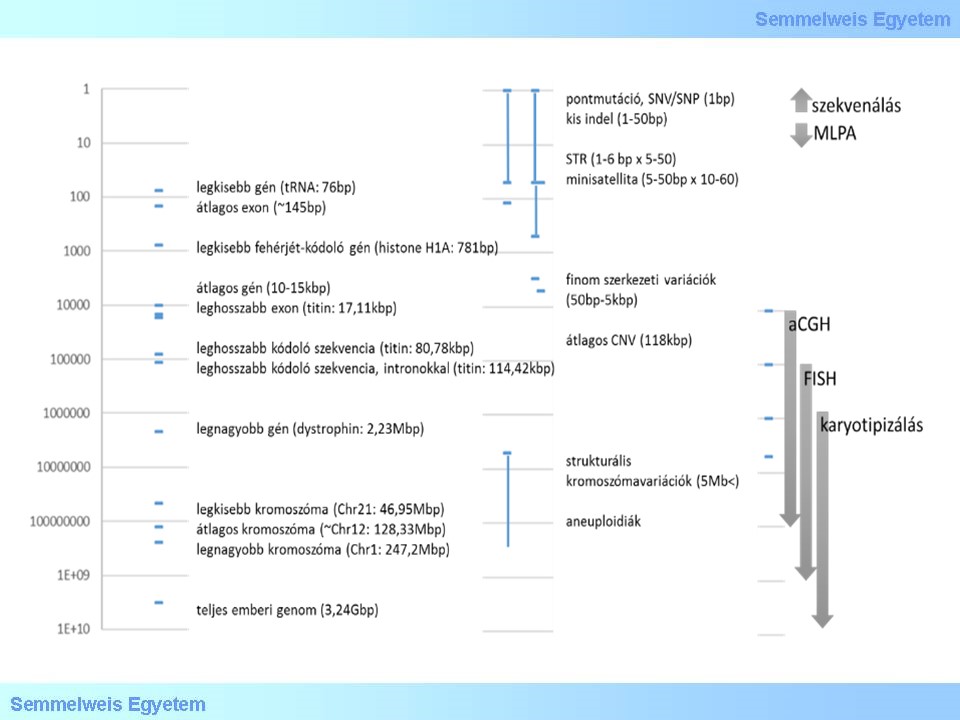
11. ábra: A genetikai eltérések spektruma: a függőleges tengelyen a bázisok száma, néhány átlagos vagy extrém példa a nagyságrendek érzékeltetésére, a mutációk típusai, végül a molekuláris genetikai és citogenetikai módszerek feloldóképessége látható
|
A diagnosztikus géntesztet azon esetekben végzik, amikor klasszikus klinikai kép, képalkotón látott eltérés, szövettani vagy akár egy laboratóriumi vizsgálat alapján felállítható egy valószínű (klinikai) diagnózis, de annak megerősítésére genetikai diagnosztikai vizsgálat elvégzése szükséges. Ha az elvégzett alapvizsgálatok után sem szűkült le egyetlen jelöltre a lehetséges betegségek köre, akkor a genetikai alapú differenciáldiagnózis vezethet eredményre.

2. táblázat: A klinikai kép és a hozzá tartozó genetikai eltérés típusának és változatosságának megfelelő módszer kiválasztása. *(a „szabad” triszómia, tri(21) mellett ritkán transzlokációs mechanizmus, sőt mozaicizmus is előfordul)
|
|

…hogy az egyes genetikai meghatározottságúnak vélt kórképek vizsgálati stratégiáját igyekezzünk optimalizálni az adott fenotípus esetében gyűjtött tapasztalatok alapján. A teljes genom szekvenálással nem fogunk rálátni például a repeat-expanziókra, a célzott Sanger-szekvenálás elől rejtve maradnak a nagyobb génátrendeződések, kromoszómamutációk stb.
|
Többszörös rendellenesség, értelmi fogyatékosság, ismert genom- vagy kromoszómális mutációnak megfelelő kórkép vagy ismeretlen, de jellegzetes szindrómának imponáló klinikai kép vizsgálatának elsőként választandó módszere a hagyományos G-sávos kariotipizálás, amely korlátozott feloldóképesség mellett ugyan, de a vizsgált sejt teljes kromoszómakészletének lehetséges számbeli és szerkezeti eltéréseiről szolgáltat információt.
Az észlelt, vagy esetleg a karyotipizálással nem észlelt, de továbbra is feltételezett, kromoszómarendellenesség részletesebb vizsgálatára különböző molekuláris citogenetikai módszerek állnak rendelkezésre. A fluoreszcens in situ hibridizáció (FISH) alkalmas a számfeletti kromoszómák, mikrodeléciók és kormoszomális átrendeződések célzott kimutatására, fluoreszcens festékkel jelzett próbával történő hibridizáltatás segítségével. A kromoszóma-preparálásnál jelentősen nagyobb feloldóképességgel történő szűrésre: mikrodeléciók, -duplikációk és kiegyensúlyozatlan kromoszómalis eltérések vizsgálatára array comparatív genomikus hibridizáció (aCGH) alkalmazható.
Tipikus megjelenésű mendeli öröklődésű kórképek, anyagcserebetegségek, mitochondriális betegségek esetében első módszerként általában célzott mutációanalízist végeznek. Ennek lehetséges módjai a restrikciós emésztés utáni gél-alapú elválasztáson majd jelölt próbával való hibridizáltatáson alapuló Southern-blot és a target DNS-szakasz amplifikációját alkalmazó PCR-alapú módszer, amelyek a célzott mutációanalízis olcsó és megbízható módszerei.
Ritka genetikai betegségek hátterében álló pontmutációk vagy kis kiterjedésű inzerciós-deléciós variánsok (indels) azonosítását célzó genetikai tesztelés a mai standard orvosi gyakorlat szerint a vizsgált betegséggel kapcsolatba hozható egyes gének (vagy ismert forrópontok) célzott, illetve releváns géneket felölelő gén-panelek szekvencia-szintű elemzésére terjed ki. Ha a vizsgált génekben nem sikerül a kóroki mutációt azonosítani, akkor újabb és újabb kandidáns génekre terjesztik ki a kutatás spektrumát. A feltételezett ritka betegségtől függően az asszociált gének funkcióvesztésének hátterében nagyobb genomiális átrendeződések vizsgálatának lehetőségét mérlegelik. Hasonlóképpen, a trinukleotid-ismétlődések emelkedett számára visszavezethető kórképek diagnosztikája gyakran speciális módszerek bevetését igényli.
Még egy jól karakterizált fenotípus és ismert gén-asszociáció fennállása esetén is gyakran előfordul, hogy az összes esetben nem találjuk meg egyetlen módszer segítségével az összes, a gén funkcióvesztését okozó eltérést.
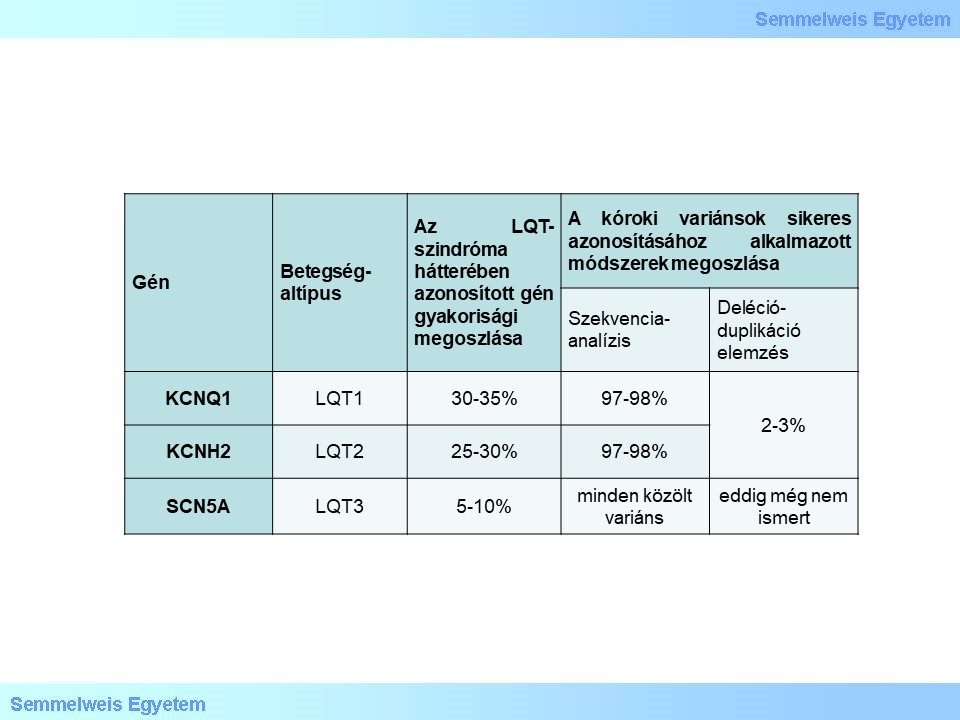
3. táblázat: A hosszú QT-szindróma hátterében ismert gének relatív előfordulási gyakorisága és a megfelelő vizsgálómódszerek mellett az azonosítás várható sikeressége
|
A felsorolásból nem maradhatnak ki azok az eltérések vizsgálatai, amikor a betegség epigenetikai eltérésekre vezethető vissza. Akár a bázissorrend megváltozása nélkül, a metilációs mintázat változik meg (imprinting defektus áll ritkán a 15q11.2-q13 régióhoz köthető Prader-Willi-, illetve az Angelman-szindrómák hátterében).
|
|