 |
XVI./ 3.2. Citogenetikai módszerek
A citogenetika fő feladata a különböző genom- és kromoszómamutációk azonosítása a preimplantációs, pre- és posztnatális genetikában.
Főbb vizsgálati módszereik a kariotipizálás, FISH (fluoreszcens in situ hibridizáció) és a komperativ genom hibridizáció, az array CGH.
A vizsgálat bármely metafázisos sejteket tartalmazó, osztódni képes sejtpopulációból történhet.
A rutin diagnosztikában legtöbbször a limfocita, csontvelő, fibroblast, szájnyálkahártya, chorion és az amnion sejtek vizsgálata terjedt el. Leggyakrabban a könnyen proliferáltathatósága miatt a limfocita vizsgálata történik.
|
 |
XVI./ 3.2.1. Kariotipizálás
A kariotípus az egyed kromoszómáinak összessége, illetve az egyed kromoszómáinak száma, alak és nagyság szerinti meghatározottsága. A kariotípust az idiogramm segítségével rögzítik. Az eljárás segítségével felismerhetők egyes kromoszóma rendellenességek illetve öröklődő betegségek.

2. ábra: Normál női 46, XX kariotípus (http://www.spectral-imaging.com)
|
|
| Érdekesség |
A kariotipizálás során a sejteket fitohemaglutinint (növényi lektin) tartalmazó médiumban 1-3 napig tenyésztik. Ez a kezelés a sejtek sejtciklusának Go-G1 fázis átvitelét segíti. Ezt követően annak elérésére, hogy minél több metafázisos sejtet kapjunk a sejteket colhicinnel kezeljük. A colhicin úgy képes gátolni az osztódási orsó működését, hogy közben ezzel a sejtciklus a mitózisba lépését nem befolyásolja. Ezt követi a hipotonizálás, amely során KCl hatására a sejtek megduzzadnak, ezáltal kromoszómák elkülönülnek egymástól, majd a metanol-ecetsav keverékben történő fixálás, és a sávozási festés (leggyakrabban Gimsa festés). A folyamat végén a kromoszómák morfológiájának, számának és szerkezetének analízise fénymikroszkóppal és specifikus szoftver segítségével történik.

3. ábra: Kariotipizálás folyamatábrája (http://mmg-233-2014-genetics-genomics.wikia.com/)
|
|
 |
Különböző sávozási technikákat különíthetünk el, mint:
-
- G-sávozás: savas-sós Giemsa festés
-
- R-sávozás: (reverz) emelt hőmérsékleten történő Giemsa festés
-
- C-sávozás: centroméra specifikus festés
-
- T-sávozás: teloméra specifikus festés
-
- Q-sávozás: quinacrin festés (fluoreszcens mikroszkópban vizsgálható)
XVI./ 3.2.2. Fluoreszcens in situ hibridizáció (FISH)
A FISH vizsgálat során a DNS fragmenseket fluoreszcens festékkel jelölünk, amely segítségével, a fénymikroszkóppal nem látható kromoszóma részleteket is azonosíthatunk. Így a FISH-el kromoszómák, kromoszómaszegmensek, mint különálló egységek, vagy akár gének tehetők láthatóvá.
|
 |
Két fő típusa van:
-
- a direkt és az
-
- indirekt FISH.
Az indirekt módszernél egy reporter molekulát mutatunk ki.
A módszer jól használható az interfázisos sejtmagokon (pl. vérkenet, vagy akár 10-100 mikrométer vastagságú szöveti metszet) vagy kromoszómapreparátumokon (metafázis) történő vizsgálatoknál.
|
 |
Jellemzői és alkalmazhatósága:
-
- Nagy érzékenység
-
- 100 bázisnyi méret alatti szekvencia is kimutatható
-
- Több DNS-szekvencia egyidejű kimutatása is lehetséges
-
- A kicsiny kromoszóma részletek kiesésével járó ún. mikrodeléciós kórképek (Prader-Willi-, Angelman-, Williams-, DiGeorge-, Miller-Dieker-,
Smith-Magenis-szindróma) célzott FISH vizsgálattal diagnosztizálhatók.
-
- Az ismeretlen eredetű értelmi fogyatékossággal társuló mikrodeléciókat a kromoszóma végdarabjait elemző szubtelomérikus próbákkal lehet kimutatni
-
- Tumor specifikus transzlokációk kimutatása

4. ábra: Egy fluoreszcens FISH felvétel (www.tibbigenetik.med.ege.edu)
|
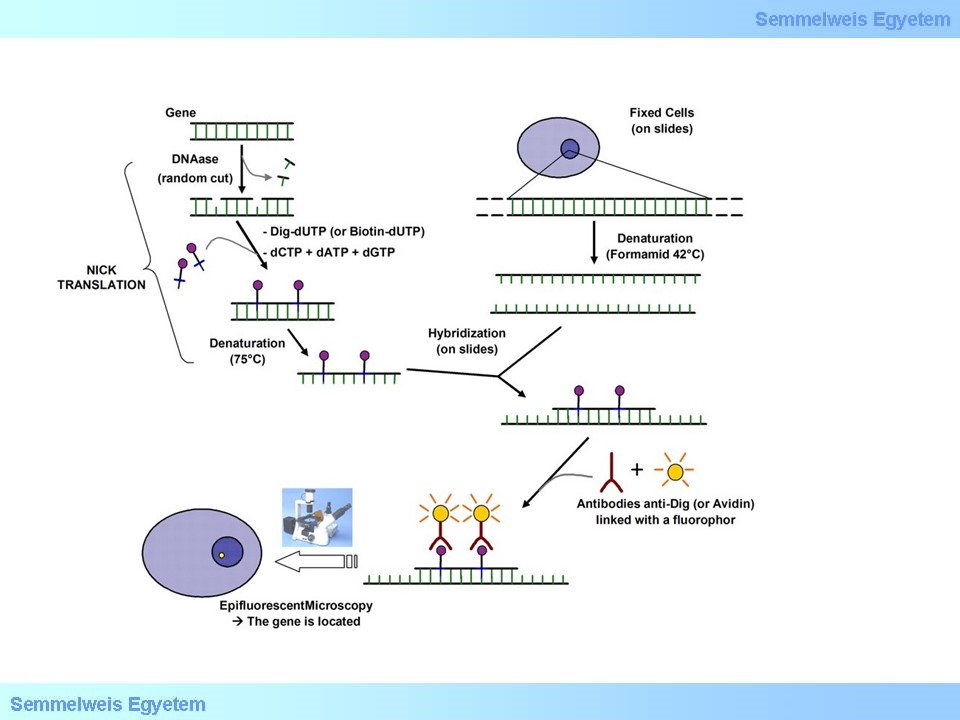
5. ábra: FISH módszer lényege www, creative-bioarray.com
|
A FISH vizsgálat speciális esete a multikolor FISH, vagy a spektrális kariotipizálás. Ennek lényege, hogy minden kromoszómát különböző színnel jelölnek meg, amely a transzlokációk elemzését nagymértékben könnyíti. Hátránya, hogy nagyon költségigényes.

6. ábra: Női kariogriotipus multikolor FISH képe (http://www.wikiwand.com/en/Karyotype)
|
|
 |
XVI./ 3.2.3. Komparatív genomikus hibridizáció (CGH)
Az aCGH segitségével a vizsgált egyén genomjában előforduló kromoszómális eltérések (relatív DNS-duplikációkról és -deléciókról) vizsgálhatók. A módszer a fluoreszcencia in situ hibridizáció elvén alapul, amelyet 1992-ben Kallioniemi és munkatársai dolgoztak ki. A felbontása, igy a vizsgálatok mélysége folyamatosan nő. 2002-be BAC alapú aCGH-et dolgoztak ki, egymást átfedő kromoszóma szakaszokat tartalmazott, így lefedte az egész humán genomot, az átlagos felbontás 75 kb-ra változott (2002). A teljes genomot reprezentáló BAC alapú array-ekre felvitt egyedi klónok száma 2,400-32,000 elem között változik, az elemszám meghatározza a felbontás mértékét is.
A módszer korlátait adja, hogy
-
- az array feloldását az inzertek mérete és a targetek közti távolság határozza meg,
-
- a gyakran ismétlődő szekvencia elemeket (pl. Alu, LINE: long interspread repeats) vagy más redundáns szekvenciákat (szegmentális duplikációk), centroméra és telomera ismétlődő szakaszait is tartalmazzák.
A módszer használható, mind pre- és posznatális, valamint a tumorgenetikában is. A megválaszolandó problémától függően irányulhat a teljes genomra, exonra vagy akár kisebb, célzott génpanelekre is.
|
 |
A vizsgálat során az egészséges egyénből származó, tárgylemezen fixált, metafázisban lévő kromoszómákat denaturáljuk és etanolban dehidratáljuk. A beteg és a referencia DNS 1:1 arányú keverékét szintén denaturáljuk (a DNS – ket előzőleg eltérő fluoreszcens festékkel jelölik). Ezt hibridizáltatjuk a normális kromoszómákat tartalmazó preparátumra, valamint a nem hibridizált DNS-t eltávolítjuk. A kromoszómákat „antifase”-ban oldott DAPI-val (kék festék, amely a DNS-t specifikusan jelzi és a G-sávozáshoz hasonló mintázatban kötődő festékkel (1,6 diamino-fenil-indol) jelöljük. Az aCGH képét e három festék eredőjéből kapjuk meg. Az analizáló szoftverek ezeket a kapott fuoreszcencia értékeket használva adják meg hogy, mely kromoszómális régió érintett, valamint az irodami adatokat és az in silico predikciókat figyelembe véve a deléció/duplikáció által okozott lehetséges szindrómát is felvázolja. (Erről bővebb infó a szindromatológiai fejezetben található).

7. ábra: aCGH folyamatábrája (Sharkey et al. Arch Dis Child 2005;90:1264-1269)
|
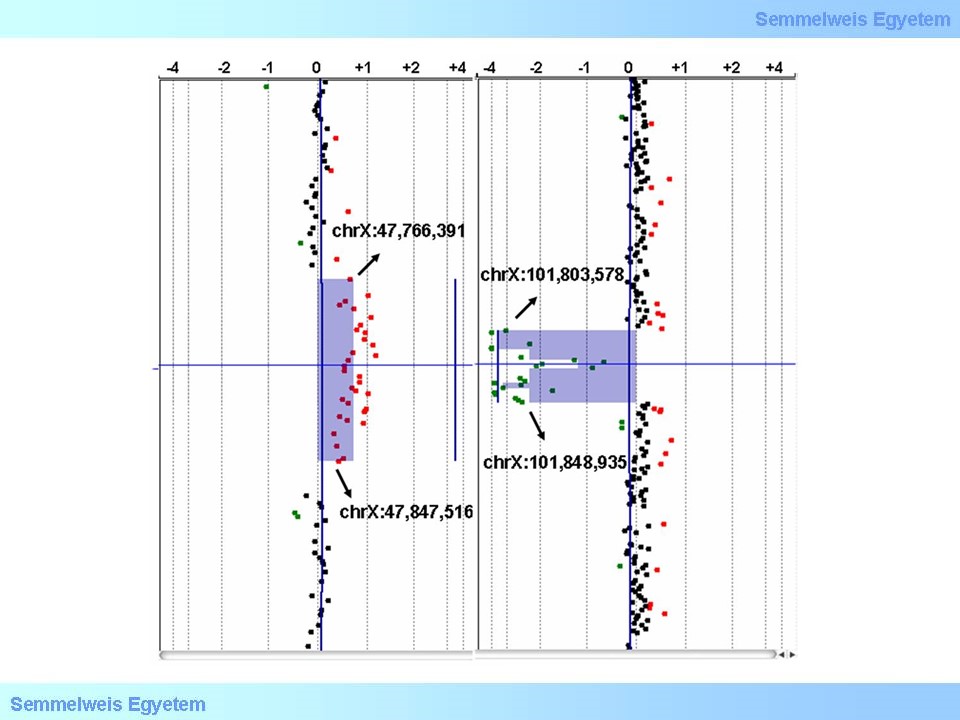
8. ábra: Kópiaszám változás (CNV) detektálása aCGH módszerrel (Krausz et al., PLoS One. 2012;7(10):e44887.)
|
|
|