 |
XVI./ 3.3. Molekuláris genetikai módszerek
A mindennapi molekuláris genetikai diagnosztika során vizsgálat leggyakrabban a genomiális DNS-en történik. Az elemzés maga irányulhat célzottan egy adott mutációra vagy génre, illetve akár a teljes kódoló régióra (teljes exom analizis) vagy akár a teljes genomra, vagy SNP mintázatokra.
XVI./ 3.3.1. DNS izolálás
A vizsgálatok elvégzésének alapfeltétele, hogy izolált DNS álljon a rendelkezésünkre. A gyakorlatban a genomi DNS izolálása történhet vérből, nyálból, szövetből, akár vizelet laphámsejtekből vagy hajhagymából.
Napjaink technológiai fejlesztései lehetőséget teremtettek arra, hogy már a plazmában keringő szabad DNS-t (cfDNS - cell free DNS) is izolálni tudjuk. Ezek a cfDNS-ek vizsgálata egyre nagyobb teret nyer a magzati- és a tumordiagnosztikában.
|
 |
A genomiális DNS izolálásának klasszikus módszerei a fenol-kloroformos vagy kisózásos technikák. Manapság ezeket a lényegesebben gyorsabb szilika membránokon, vagy mágnesgyöngyökön történő izolálási technikák háttérbe szorították. A módszer azon alapul, hogy a nukleinsavak magas sókoncentráció mellett szelektíven kötődnek a szilika membránhoz vagy a szilikával bevont mágnesgyöngyhöz. A DNS izolálás első lépéseként hipotóniás oldatban a vizsgálandó minta sejtes elemeinek lizálása valamint a proteinek proteinázzal (leggyakrabban proteináz K) történő kezelése történik. Ezt követően a lizátumban lévő nukleinsav az abszorbens felületre tud kötődni, amelyet specifikus mosásokat követően alacsony sókoncentrációjú pufferrel oldjuk le (általában 10mM TRIS-HCL, 1mM EDTA, pH: 8,5-9).

1. ábra: Genomi DNS izolálásának folyamata (http://www.fairbiotech.com)
|
XVI./ 3.3.2. PCR alapú technológiák
A molekuláris genetikai diagnosztika alapja a PCR (polimeráz láncreakció), amely a DNS vizsgálandó szakaszát DNS polimeráz enzimekkel, kontrollált megismételt ciklusok által mesterségesen megsokszorozza. Az elmúlt 2-3 évtizedben ez a metodika forradalmasította a molekuláris genetikai vizsgálati módszereket, mivel a jelenleg használt módszerek szinte mindegyike ezen alapelv alapján működik.
|
 |
Magát a PCR módszert 1983-ban Kary Mullis fedezte fel, amiért 1993-ban Nobel díjat kapott. Az első hőstabil DNS- polimerázt a hőforrásokban élő Thermus aquaticus baktériumból nyerték, amelyet ma már rekombináns technológiákkal nagymennyiségben gyártanak. Ezt az enzimet Taq polimeráznak nevezték el. A vizsgálandó DNS szakaszát a specifikus primerek határozzák meg. Ezek az oligonukleotidok (primerek) a vizsgálandó DNS szakasz mindkét végét behatároló azzal komplementer, a DNS mindkét szálára specifikusan tervezett egyszálú DNS szakaszok. A DNS szintézise 5’- 3’ irányban folyik, így az egyes ciklusokban a két primer közti DNS szakasz kerül szintetizálásra.
A reakció egy kezdeti denaturációból, ciklusok során a denaturáció, a hibridizáció (annelláció) és szintézis lépései folyamatosan ismétlődnek. A denaturációnál a kettős DNS szálat 95°C-on egyszalúsítjuk, ami megteremti a hibridizációs lépés során a specifikus oligonukleotidoknak, a primereknek a bekötődését. Ezt követően a Taq polimeráz segítségével megtörténik az adott szakasz szintézise.
A PCR reakcióhoz szükséges egy hőstabil DNS polimeráz enzim, az enzimnek megfelelő pufferek (ezek adják amegfelelő pufferek (ezek adják a megfelelő ionerőt és sókoncentrációt), a nukleotidok felépítését biztosító dezoxi-nukleotidok (dNTP) és a MgCl2. Az enzimet korábban a hőforrásokban élő Thermus aquaticus baktériumból nyerték. A ma használt Taq polimerázokat már rekombináns technológiával állítják elő.
|
 |
Minden ciklus egy denaturációs lépéssel kezdődik, amely során 95C-on a DNS kettős szálait összekötő hidrogén hidak felbomlanak. Ezt követően egy hirtelen hűtéssel 50-65C közöttkövetkezik a hibridizáció, a templáthoz (a genomiális DNS primerekkel komplementer szálaihoz) az oligonukleotid primerek hibridizálnak. A cikulus befejezéseként 72oC on szintetizálódik az új DNS szál. A ciklusok után egy 72C-on egy végső szintézis következik be. A DNS minden ciklusban megkettőződik, igy mennyisége hatványozottan emelkedik. A folyamat végén a DNS koncentráció 2n-en, ahol az n a ciklusok hossza.
2. ábra: PCR első ciklusának sematikus ábrája (http://www.j-pcs.org/viewimage.asp?img=JPractCardiovascSci_2015_1_2_168_166338_f3.jpg)
|
Felirat: PCR reakció folyamatábrája (https://www.slideshare.net/ankit_2408/polymerase-chain-reaction-12241254)
|
XVI./ 3.3.2.1. Leggyakrabban használt PCR típusok
Standard PCR: pontmutációk és egyéb, néhány nukleotidot érintő változások detektálására alkalmas módszer (RFLP vagy Sanger szekvenálást megelőző vizsgálat)
|
 |
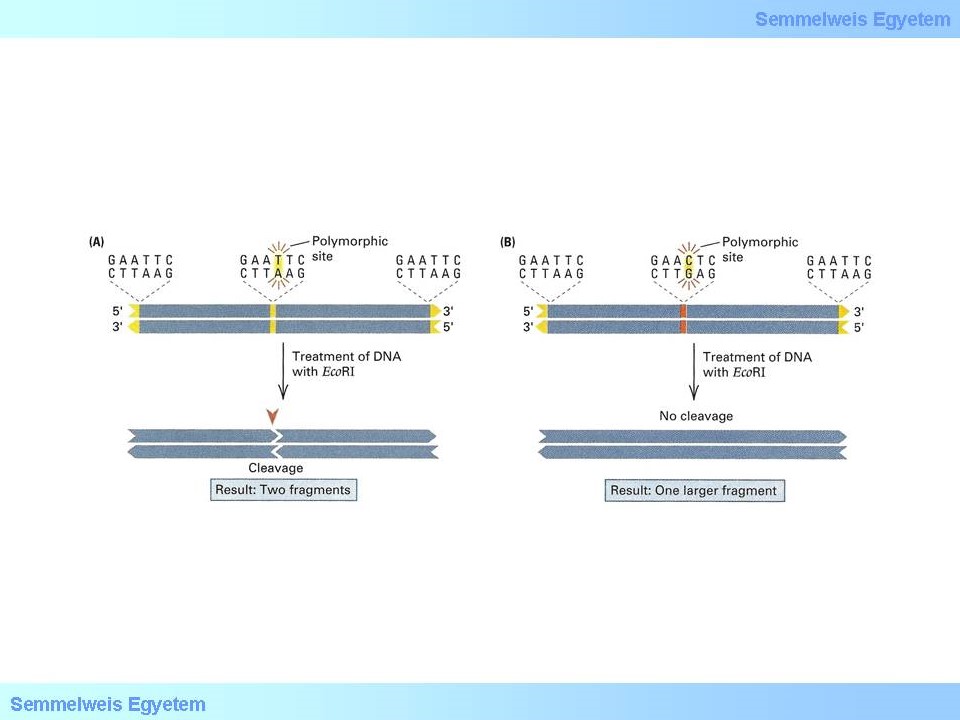
Sok esetben a vizsgálat célja egy adott mutáció kimutatása. Ezek lehetnek nukleotid cserével járó mutációk (SNV-k (single nukleotid variáns), vagy ismétlődő tandem szekvenciák (VNTR-ek).
Az SNV-ket a restrikciós fragmenthossz polimorfizmus (RFLP) vizsgálattal mutathatjuk ki. A PCR reakció során ampifikált PCR terméket a restrikciós endonukleázokkal hasítjuk, majd a kapott termékeket gélelektroforézissel választjuk el. Az elektroforézist követően az adott genotípusra jellegzetes mintázatot kapunk, amely alapján a beteg adott mutációra vonatkoztatott genotípusa könnyedén meghatározható. A restrikciós endonukleázok nagy szekvencia specificitásúak, amelyet az enzim hasitó és felismerő helye biztosít.

1. ábra: PCR-PFLP sematikus ábrája (http://biomolmishellvargas.blogspot.com/2015/11/pruebas-de-aflp-y-rflp-en-pacientes-con.html)
|

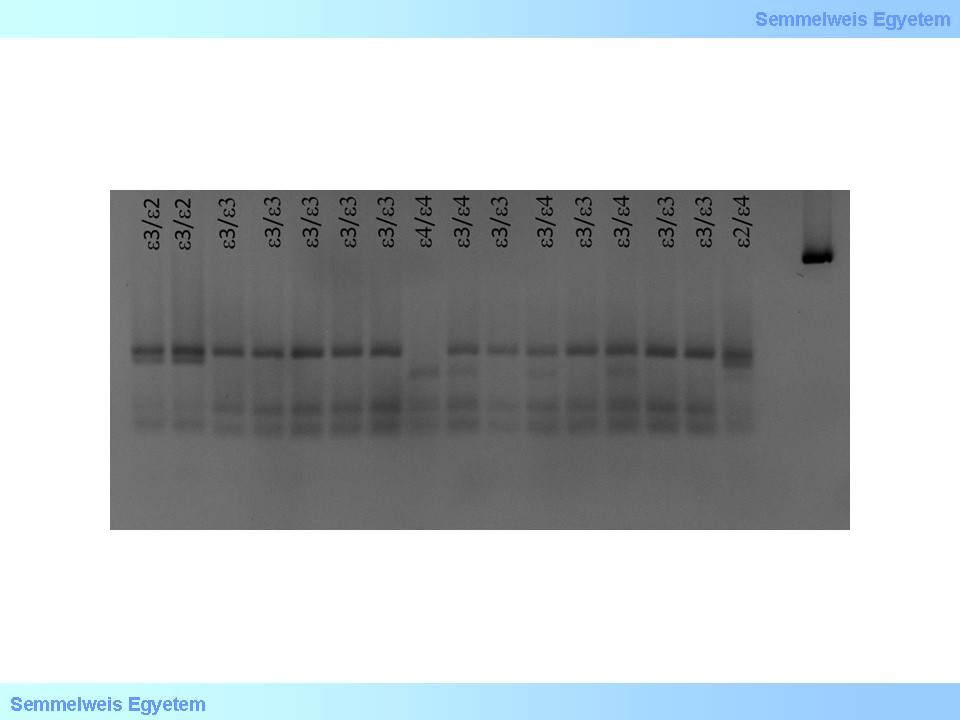
2. ábra: APOE genotipusok elkülönitése PCR-RFLP módszerrel (Fotó: SE-GRI)
|
|
| Érdekesség |
A VNTR variációk kimutatása azon alapul, hogy a tandem ismétlődő szakaszok allélonkénti száma változó lehet. Nagyobb méretű szakaszokat könnyen egy PCR reakciót követő gélelektroforézissel is meghatározhatjuk.

3. ábra: VNTR mutációk kimutatásának sematikus ábrája (biology.mwit.ac.th)
|
Multiplex PCR: több génszakasz egyidőben történő amplifikációja és az azt követő elektroforézissel való kimutatása. Könnyű és gyors módszer a homo- és hemizigóta deléciók kimutatására. (Heterozigóta deléciók esetében nem alkalmazható, mert az adott gén egy kópiája is elég az amplifikációhoz). Ezt a módszert használhatjuk pl férfiakban a Duchenne/Becker féle izom dystrophia kimutatására.

4. ábra: Dystrophin gén delécióinak kimutatása multiplex PCR-el (P2 és P3 – Exon 50-52 deléció; P5 - Exon13, 17, 19 deléció (Fotó: SE-GRI)
|
Long range PCR: a Taq polimeráz mellett a rekcióhoz egy exonukleáz aktivitással rendelkező enzimet használnak. Ez az exonukleáz felel azért, hogy a reakcióban rosszul beépülő nukleotidokat kivágja. Ezzel a módszerrel nagyobb (>1000 bp) szakaszok vizsgálhatóak.
|
| Érdekesség |
Jól használható:
-
- aCGH validálására a töréspontokra tervezett primerek segítségével,
-
- Mitokondriális deléciók kimutatására,
-
- Pszeudogének hatásának kiküszöböléseére,
-
- Egyes trinukleotid repeatek vizsgálatára (pl. a Friedreich ataxia molekuláris diagnosztikájában).

5. ábra: Afibrinogenaemia hátterében álló fibrinogen (FBG) gén 15kb-os deléciójának kimutatása (Spena et al., Eur J Hum Genet. 2004 Nov;12(11):891-8.)
|

6. ábra: Mitokondriális deléciók kimutatása (P1, P2. P3, P4 – multiplex mtDNS deléciók, P5, P6 – normál, nincs deléció, P7 – egyszeres deléció) (Fotó: SE-GRI)
|
|
 |
Kvantitatív, valósidejű PCR:
A mintában lévő DNS/cDNS mennyiségének meghatározására alkalmas, fluoreszcens detektáláson alapuló valós idejű PCR módszer. A PCR reakció egyes ciklusaiban keletkező PCR termékekhez kötődő fluoreszcens festék vagy fluoreszcensen jelölt hibridizációs próba segítségével vizsgáljuk a PCR termék mennyiségét jelző fluoreszcencia intenzitást.
A reakció után az analizáló program meghatározza azt a ciklust, amelyben a PCR termék fluoreszcenciája már éppen meghaladta a háttér fluoreszcenciáját, amely az áttörési pont, vagyis a Ct érték. Amennyiben ismert DNS koncentrációjú standardokat használunk, akkor az így kapott standard görbe alapján a vizsgálandó DNS szakasz koncentrációja, vagy kópiaszáma is meghatározható.
PCR-t követően olvadáspont analízis is elvégezhető, amely arányos a DNS összetétellel, GC arányával és hosszával. Ennek alapján a fragmensek azonosíthatóak.
|
| Érdekesség |
Két kémiai megközelités létezik:
-
- SybrGreen – interkalálódó festék, ha van termék zöld fluoreszcenciát mutat
-
- TaqMan próba – két hagyományos primer próba és egy hibridizáló próba a kettő között
Rutin diagnosztikában jól használható pl.:
-
- SMN1 gén ex7 deléció kimutatása,
-
- mtDNS depléció vizsgálata,
-
- Pontmutációk vizsgálata.
-
- mRNS expressziók mérése,
-
A t(9;22) (bcr/abl) transzlokáció kimutatására és a keletkezett bcr/abl transzkriptek mennyiségének meghatározására,
-
- Virus titerek meghatározására.
|
| Érdekesség |
Digitális PCR
A digitális PCR (dPCR) a hagyományos PCR tovább fejlesztett változata, amellyel lehetőség van a DNS klonális amplifikációjára illetve a direkt kvantifikálására. A hagyományos PCR és a dPCR közötti különbség a DNS mennyiség meghatározásának módjában rejlik. A hagyományos PCR során egy adottmintában egy reakció játszódik le. A dPCR-ben is egy reakció játszodik le a mintán belül, azzal a különbséggel, hogy a minta több száz részre/particióra van osztva, és mindegyik particióban egy-egy reakció játszódik le.
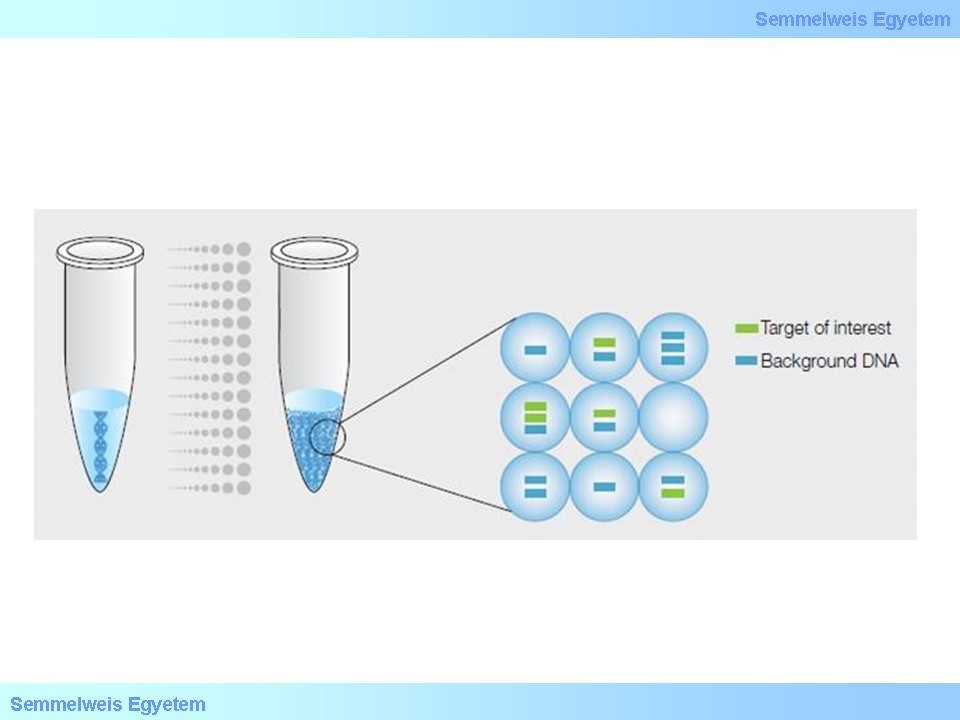
10. ábra: Hagyományos PCR versus digitális PCR (http://www.bio-rad.com)
|
A dPCR elönye a többi PCR tehnikával szemben, hogy az egy reakció helyett több száz kisebb térfogatban lejatszódó reakcióra bontja. A minta több kisebb részre van osztva, ily módon egyedi DNS molekulák találhatók egy egy particióban ahol aztán amplifikálodik. A minta particionálására különböző eljárások vannak: olaj emulzió, kapilláris, mikrochipek, stb. A PCR reakció hasonlit a TaqMan assay-hez: DNS/RNS template, fluorescensen jelölt probe, primerek, PCR master mix (DNA polymerase, dNTP, puffer). A PCR reakciót követően a minden egyes particióban fluoreszcens jelet vizsgálják.

11. ábra: Fluoreszcensen jelölt molekulák olajcseppekben
|
A digitális PCR alkalmazási teruletei:
-
- NGS könyvtár ellenőrzése,
-
- folyadék biopszia (liquid biopsy)
-
- kópia szám változás meghatározás,
-
- gén expresszió és mikroRNS vizsgálata,
-
- egy sejt DNS állományának vizsgálata (egy sejt PCR),
-
- patogén mutációk detektálása,
-
- ritka mutációk meghatározása,
-
- kemoterápiák hatékonyságának ellenőrzése,
-
- genom editing
|
|