 |
XVII./ 2. Hogyan változtathatják meg a genetikai faktorok egy gyógyszer hatásait?
Az egyének közti változatosság és az egyes egyének esetén tapasztalt megismételhetőség (nagy valószínűséggel a megismételt kezelés a korábbi jó/gyengébb hatású kezeléssel egyező eredményt ad) erősen sugalmazta, hogy nagy szerepe van a farmakogenetikai hatásoknak.
Tradicionálisan négy kategóriába csoportosítják a genetikai variabilitás hatását egy gyógyszer farmakológiai tulajdonságaira:
-
1. Farmakokinetikai hatás
-
2. Farmakodinamikai hatás
-
3. Idioszinkratikus reakció
-
4. Betegség kórfejlődés hatás
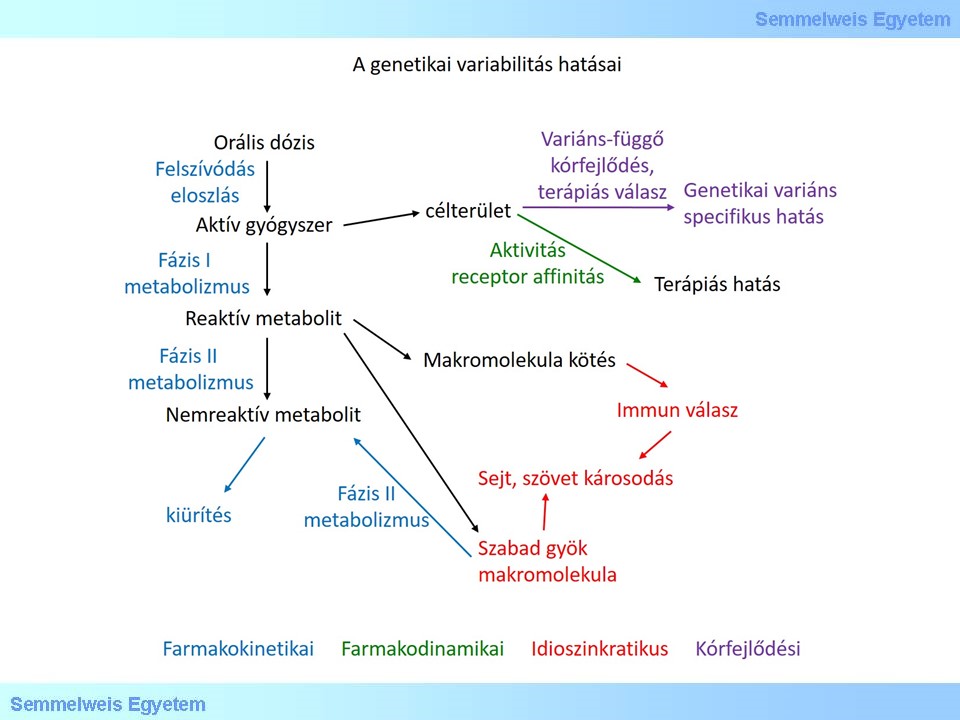
11. ábra
|
|
 |
XVII./ 2. 1. Farmakokinetikai hatás
A gyógyszert metabolizáló enzimek genetikai variánsai befolyásolják a gyógyszer plazma koncentrációját. A farmatokinetika magába foglalja a gyógyszer útvonalát és metabolizmusát a szervezetben. A legtöbb farmakogenetikai tanulmány erre a területre koncentrál, azon belül is a gyógyszereket metabolizáló vagy transzportáló enzimek genetikai variánsaira.
Az idegen anyagok (xenobiotikum) metabolizmusának két fázisa van, melyekben több száz metabolizáló enzim vesz részt.
-
- A I. Fázis enzimei oxidáció vagy redukció által növelik a gyógyszer polaritását (vízoldhatóságát). Ezeket a reakciókat a citokróm P450 (CYP) enzimek katalizálják elsődlegesen.
-
- A II-es fázis enzimei konjugáció által fokozzák a gyógyszerek polaritását, ami segítségével az anyag a vizelettel eltávozik a szervezetből. A II. fázis enzimeinek is vannak farmakogenetikai szempontból fontos polimorfizmusai.

1. ábra
|
XVII./ 2. 1. 1. A gyógyszer metabolizmus farmakogenomikája
XVII./ 2. 1. 1. 1. Citokróm P450 szupercsalád enzimei és gyógyszer metabolizmus
A CYP család enzimei felelnek a legtöbb idegen anyag oxidatív metabolizmusáért. A humán genom szekvenálás 58 CYP gént detektált. A CYP enzimek aktivitása genetikai és környezeti hatásoktól függhet, például számos gyógyszer gátolja a CYP3A4 aktivitását, ami jelentősen befolyásolhatja egy másik gyógyszer metabolizmusát. Farmakogenomikai szempontból nagyon fontosak a CYP enzimek, mert számos polimorfizmust hordoznak, amelyek lakosság jelentős hányadában befolyásolják a gyógyszerek metabolizmusát. Nagyon sok esetben az etnikai háttér is befolyásolja a variánsok valószínűségét. A CYP enzimek variánsai a farmakogenetikai biomarkerek jelentős hányadát teszik ki.
XVII./ 2. 1. 1. 2. CYP enzimek fenotípusai
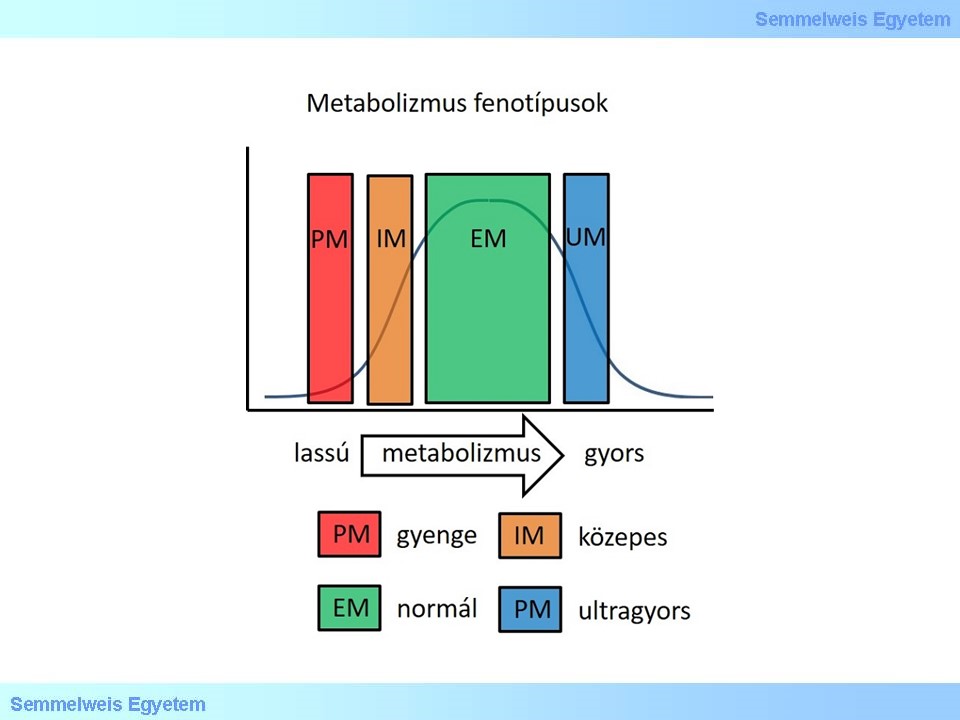
1. ábra
|
|
 |
A CYP gének variánsai miatt egy CYP enzimnek többféle fenotípusa lehet. Bizonyos egyénekben kettőnél több kópiában létezhet egy CYP gén, ami ultragyors metabolizmust eredményez (UM), akikben két normál aktivitást eredményező kópia van, azok normál metabolizálók (extensive, EM), akinek egy normál és egy inaktív variánsa van, azok közepesen metabolizálók (intermediate, IM), akiknek pedig két inaktív vagy csökkentett aktivitású variánsa van, azok a gyengén metabolizálók (poor, PM). A klinikai szempontból legfontosabb polimorfizmusok a CYP2C9, CYP2C19, CYP2D6 és a CYP3A4 génjeiben vannak. Ez a négy enzim a ma használt gyógyszerek 60-70%-ának az oxidatív metabolizmusáért felel. A CYP enzimek polimorfizmusainak fontosságát mutatja, hogy külön weboldal tartalmazza azokat, amit folyamatosan frissítenek!
|
 |
XVII./ 2. 1. 1. 3. A gyógyszer metabolizmus lényeges farmakogenomikai példái
XVII./ 2. 1. 1. 3. 1. CYP2C19 variánsok és clopidogrel
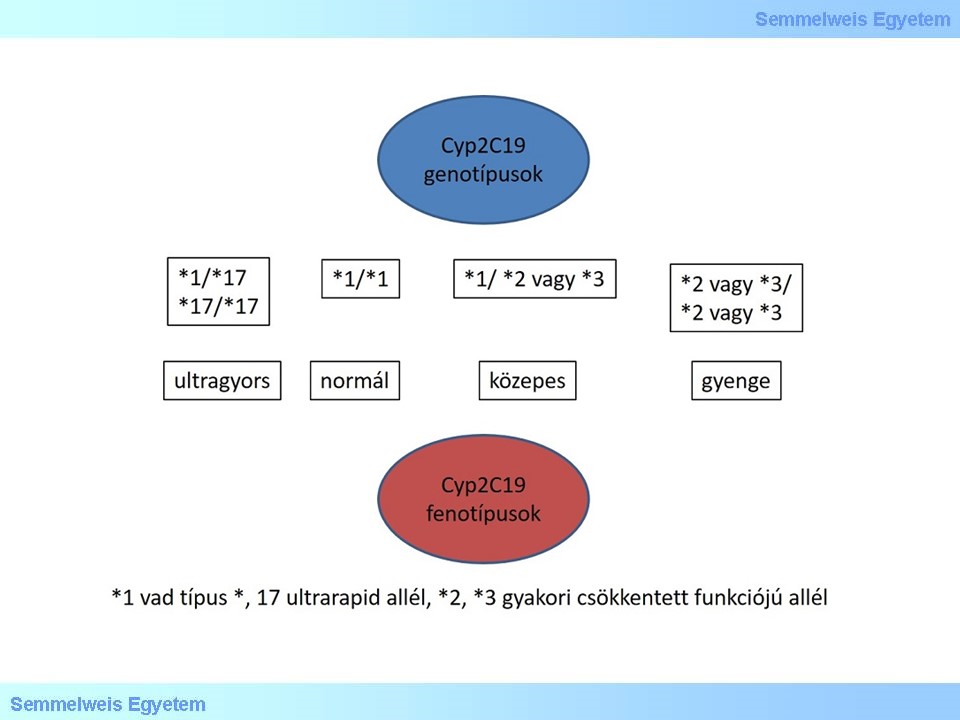
2. ábra
|
A csökkentett funkciójú anti-trombocita ágens clopidogrel káros hatásáról több analízisben számoltak már be. Az FDA (US Food and Drug Administration) figyelmeztette a klinikusokat, hogy genetikai tesztelés elérhető, mert a gyengén metabolizáló CYP2C19 genotípusú paciensek esetében a Clopidogrel nem éri el a kívánt hatást és vagy dózis változtatás vagy egy másik gyógyszer használata javasolt.
XVII./ 2. 1. 1. 3. 2. CYP2D6 variánsok
A CYP2D6 kirívóan sok polimorfizmust hordoz, több mint 90 variánsát írták le. A CYP2D6 több jelentős gyógyszer metabolizmusáért felel, például codein, nortriptylin, metoprolol, vagy a szelektív szerotonin-újrafelvételt gátló (SSRI) simvastatin és tamoxifen.
A codein és a nortriptylin példája mutatja, hogy mennyire eltérő hatású lehet a CYP2D6 ugyanazon variánsa két különböző gyógyszer farmakokinetikai profiljára. A codein egy prodrug, amit a CYP2D6 alakít át a fájdalomcsillapító hatású morfiummá. Ezzel szemben a nortriptylin aktív ágens, amit a CYP2D6 inaktivál. Gyengén metabolizáló CYP2D6 genotípusú betegek esetében a codein nem eredményez terápiás hatást, mivel nem aktiválja a CYP2D6, viszont nortriptylin esetében a túladagolás veszélye és káros mellékhatások kialakulása áll fenn. Ezzel szemben a CYP2D6 ultragyors metabolizálók esetében magasabb morfium szint alakul ki, ami több mellékhatással és csökkentett időtartamú fájdalom csökkentéssel párosul, viszont ezek a betegek esetében a nortriptylin valószínűleg nem éri el a kívánt terápiás hatást, mert túl gyorsan metabolizálódik a gyógyszer.
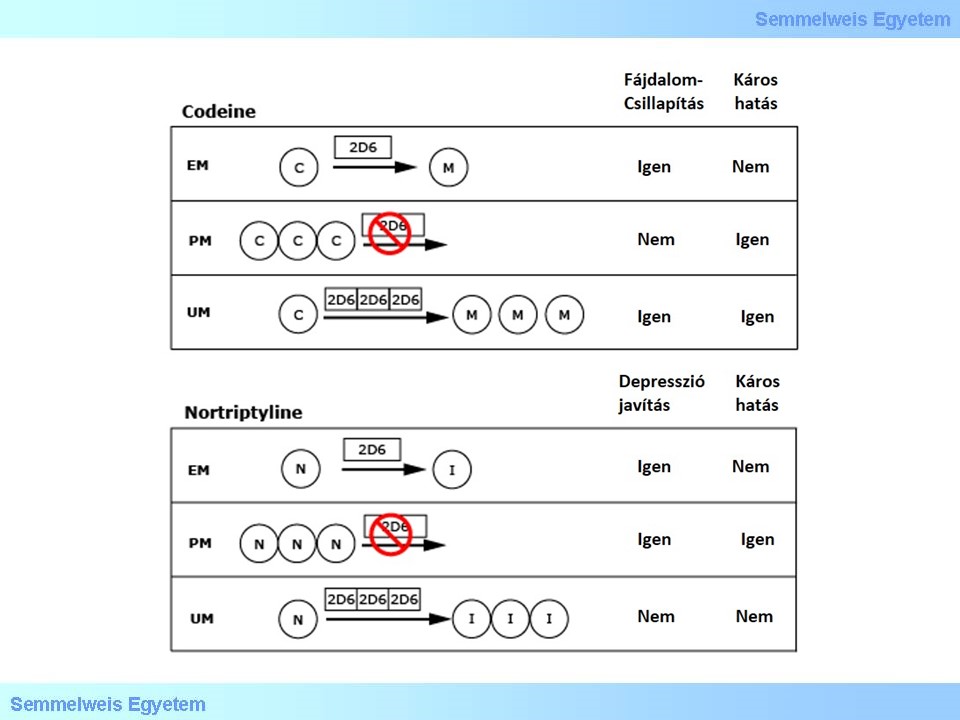
3. ábra
|
|
 |
XVII./ 2. 1. 1. 3. 3. Tiopurin metabolizmus
Nem csak a CYP izoenzimek polimorfizmusai vannak a gyógyszerek farmakokinetikájára hatással, a II-es fázisra jó példa a tiopurin S-metiltranszferáz (TMPT). TMPT a tiopurinok, mint például az azatioprin és a 6-merkaptopurin metabolizmusáért felel. TMPT polimorfizmusok eredményezhetnek teljesen inaktív, vagy csökkentett aktivitású enzimet, ami kezelés-függő leukopéniát okozhat. (53-56) Már 24 alacsony funkciójú variánst észleltek, de a két leggyakrabb, a TMPT*2 és *3 a hibás TMPT allélek 95%-ában található meg. Az emberiség 10%-ának csökkentett TMPT aktivitása van és 0,3%-ának egyáltalán nincs detektálható TMPT aktivitása. Azatioprin esetében az FDA javaslat a „TMPT genotípus vagy fenotípus figyelembe vétele”, míg 6-merkaptopurin kezelés esetén genotipizálást csak bizonyított súlyos toxicitás, leginkább myeloszupresszió esetén javasolnak.
XVII./ 2. 1. 2. Gyógyszer transzportálás farmakogenomikája
Farmakogenetikai szempontból a farmakokinetika másik fontos területe a gyógyszer transzportálás örökletes variánsai. Több példa is jól illusztrálja ennek a területnek a klinikai fontosságát
XVII./ 2. 1. 2. 1. Nem-nukleotid reverz transzkriptáz gátlók hatékonysága
Az ABC-transzporterek (ATP-kötő kazetta transzporterek) a gyógyszer eloszlás és aktivitás szempontjából az egyik legintenzívebben kutatott fehérjék. Ide tartozik a P-glikoprotein, melyet az ABCB1 (más néven MDR1) gén kódol. P-glikoprotein növeli az energia-függő celluláris beáramlását többféle anyagnak, többek között több antivirális ágensnek. Több tanulmány foglalkozott azzal, hogy bizonyos polimorfizmusai az ABCB1 génnek prediktálják-e a gyógyszer plazma koncentrációját, virológiai hatásfokát és toxicitását HIV-fertőzött betegekben. Több tanulmány kimutatta a 3435C>T variáns hatását, bár a hatásmechanizmusra még nem derült fény.
XVII./ 2. 1. 2. 2. sunutinib-függő toxicitás
A többcélpontos tirozin kináz gátló sunitinib előrehaladott vesesejtes rák kezelésére alkalmaznak. Egy tanulmány kimutatta, hogy több mellékhatás, például a nyálkahártya gyulladás és a kéz-láb szindróma gyakorisága és a súlyossága szignifikánsan magasabb volt azokban a betegekben, akik az ABCB1 és az ABCB2 gének bizonyos haplotípusait örökölték.
XVII./ 2. 1. 2. 3. Az organikus anion transzporter család polimorfizmusai
A lymphoma leukémia, osteosarcoma kezeléséhez használt magas dózisú metotrexát plazma koncentrációja nagyon változó. Különféle örökletes polimorfizmusok befolyásolják a metotrexát farmakokinetikáját, toxicitását és hatásfokát. Egy példa, az SLCO1B1 gén kódolja az organikus anion transzporter polipeptid 1B1-et (OATP 1B1). Ez a peptid a hepatocita membránban lokalizált és a szinuszoid vérben található szubsztátok felvételét segíti elő. Az SLCO1B1 polimorfizmusai és az OATP 1B1 szintje fontosnak ígérkezik a metotrexát plazma szintjének és toxicitásának szempontjából. Az SLCO2B1 variánsait pedig montelukast plazma szintjével, illetve asztma válaszának hatékonyságával hozták kapcsolatba.
XVII./ 2. 1. 2. 4. Statin indukált myopathia
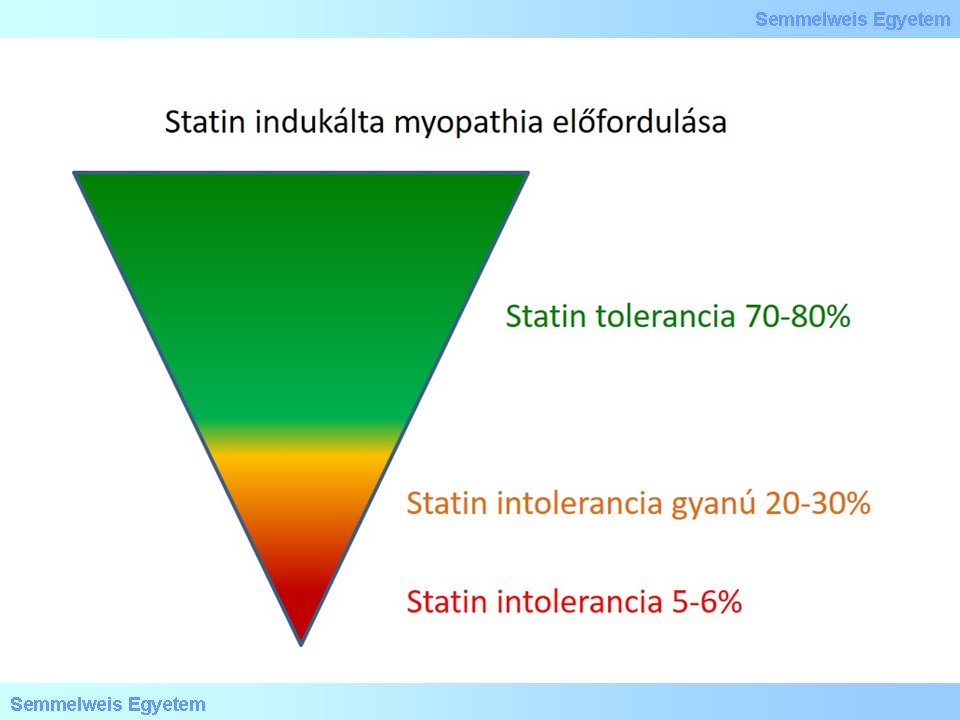
4. ábra
|
A statin indukálta myopathia kialakulásának számos kiváltó oka lehetséges, de mivel a legtöbb genetikai eltérés a statin transzportálással függ össze, a Ritka Betegségek Intézetében végzett tanulmány ehhez a szekcióhoz kapcsolódik. Intézetünkben öt statin indukálta myopathiával összefüggésbe hozott polimorfizmust vizsgálunk. Az irodalom alapján ezeknek a korrelációja nem mindig statisztikailag szignifikáns, ezért genotipizálással és a genotípus és a fenotípus összevetésével próbáljuk meghatározni, hogy az öt vizsgált polimorfizmus (KIF6 (rs20455), CoQ2 (rs4693570), ATP 2B1 (rs17381194), SLCO 1B1 521T>C (rs4149056) SLCO 1B1 388A>G (rs2306283) összefüggésbe hozható-e a statin indukálta myopathia kialakulásával az általunk vizsgált betegekben.
|
|