| |
III./2.3.: A GIST-ek jellemzői
III./2.3.1.: Fogalom-meghatározás, bevezető megjegyzések
|
 |
A gastrointestinalis stromalis tumor (GIST) a gyomor-bélrendszerleggyakoribb mesenchymalis daganata, amely olyan mesenchymalis progenitorból ered, amely (i) a gyomor-bélhuzam ritmusszabályozó (pacemaker) sejtjeiként számon tartott Cajal-féle (c-kit/CD117-pozitív) interstitialis sejtek, (ii) simaizomsejtek (SMA-pozitív), illetve (iii) perineuralis fibroblast (CD34-pozitív) sejtek irányába történő phenotypicus differenciáció különböző szintjeiig eljutott sejtekből áll.
Az irodalomban bizonyos mértékű következetlenség tapasztalható a c-kit, a KIT és a CD117 kifejezések használatában, amennyiben ezeket mind a GIST-fogalomkörben jelentőséggel bíró receptor fehérjéjének, mind az ezt kódoló génnek a megnevezésére egyaránt használják. A tisztánlátás érdekében célszerű, ha leszögezzük, hogy a ’KIT’ megnevezést a gén, míg a ’c-kit/CD117’ megnevezést a fehérjemolekula (a receptor) jelölésére, következetesen szétválasztva használjuk, hiszen – mint alább látjuk is – az elméleti háttér amúgy is bonyolult, és nem is minden részletében feltárt. Az alábbiakban tehát kerülni fogjuk az olyan, egyes forrásokban olvasható kifejezéseket, mint ’KIT-protein’, vagy még inkább ’KIT pozitivitás/negativitás’, mely utóbbiról néha nem világos, hogy a szerzők a gén mutációjára, avagy a proteintermék expressziójára használják-e.
III./2.3.2.: Előfordulás
A GIST-ek általános előfordulási gyakoriságát (incidencia) 10-20 beteg/millió lakos értékre becsülik, ideértve az incidentalis minimalis tumorokat is (ld. ott). Topográfiailag a gyomorból indul ki e tumorok 60%-a (1. rajz), a nyombélből (duodenum) 4-5%-a, az éhbél-csípőbél (jejunum-ileum) szakaszokból 20-30%-a (1. makrokép). Egyéb ritkább kiindulási helyek: nyelőcső (<1%), epehólyag, vastagbél és appendix (1-2%), végbél (4%). További ritka kialakulási helye a cseplesz (omentum) (2. makrokép), a bélfodor (mesenterium), a retroperitoneum; ezek GIST-jeit mint ún. extragastrointestinalis GIST-eket foglalnak össze .
|

Tekintse meg a képeket és elemezze a látottakat!
|
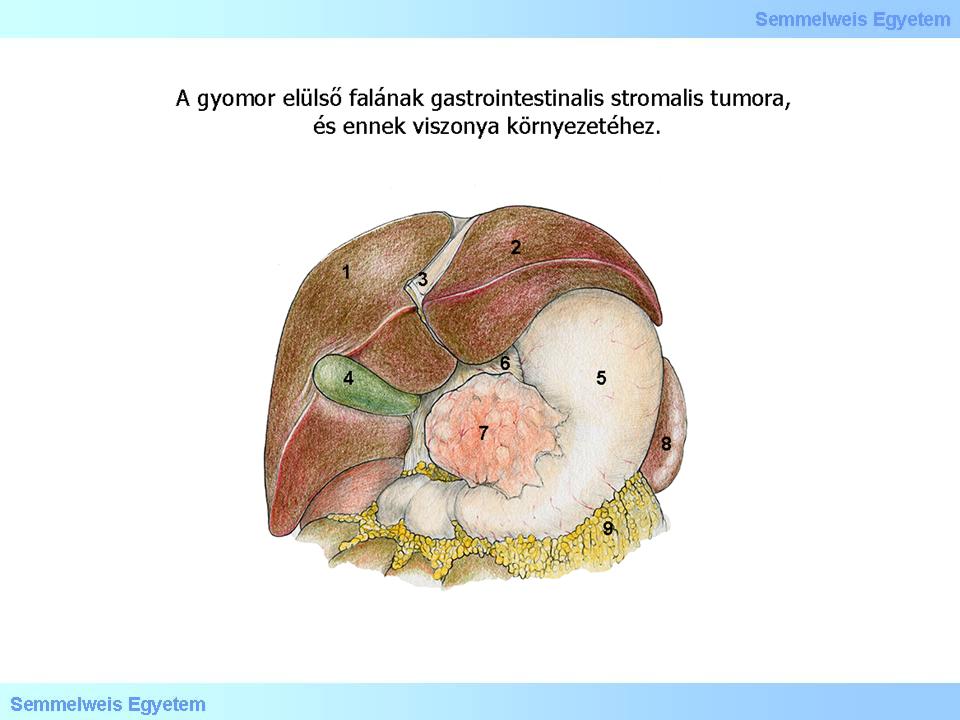
1. rajz: A gyomor elülső falának gastrointestinalis stromalis tumora, és ennek viszonya környezetéhez. (1) Lobus hepatis dexter; (2) Lobus hepatis sinister; (3) Ligamentum falciforme hepatis; (4) Vesica felleae; (5) Ventriculus; (6) Omentum minus; (7) Tumor ( GIST ); (8) Lien; (9) Omentum majus
|

1. makrokép: GIST a vékonybél falában. A daganatgóc a bélfalból emelkedik elő, és a külső felszínt előboltosítva, kifelé nő, dudoros, mindazonáltal határai élesek.
|
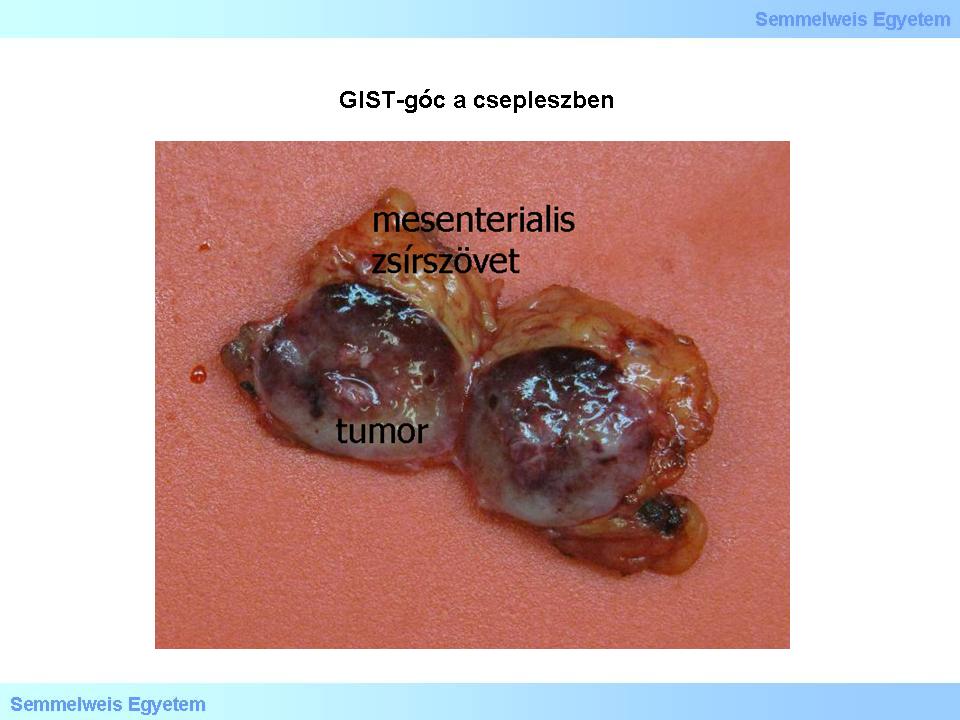
2. makrokép: GIST-góc a csepleszben. A cseplesz zsírszövetéből az éles tumorhatárok miatt takarékos kimetszéssel eltávolított daganatgöb.
|
Gyermekkorban igen ritkák (<1%), korbeli előfordulási gyakoriságot tekintve a sporadikus GIST-ek 60-62 éves kor körül a leggyakoribbak, azonban bizonyos speciális és a sporadikus változatoknál ritkább előfordulású kórképekben (GIST-szindrómák, gyermekkori GIST-ek, ld. ott) a korbeli előfordulási csúcs ettől eltér. A legtöbb GIST sporadikus, csak néhány családnál írtak le csírasejtes (germline) mutációt a KIT- (ld. alább), illetve a PDGFRA- (vérlemezke eredetű növekedési faktor receptor-alfa – egy, a c-kit/CD117-hez hasonló, ezért ugyanolyan hatású receptor-tirozinkináz) gén vonatkozásában.
III./2.3.3.: Megjelenési formák, dignitási változatok
|
 |
A GIST-ek spektruma a kicsiny, indolens, incidentalisan felfedezett tumorocskáktól (tumorlets – ld. ott) a nagy, részben necroticusan széteső, metastatizáló és akár minden lehetséges helyre kiterjedő sarcomáig terjed. Utóbbi gyakorisága 20-30%. Általános tapasztalat, hogy a jóindulatúnak véleményezett daganatok is, akár viszonylag későn (évek múltán) kiújulhatnak, késői metastasisok jelenhetnek meg, illetve a helyén hagyott tumor is lassan, de fokozatosan nő. Ezért ma már jóindulatú GIST-ről beszélni helytelen, általános megítélés szerint a tumort mindig mint legalább ’bizonytalan vagy határeseti dignitásút’ (low malignant potential – LMP, borderline) kell számon tartani.
Egyes szerzők azonban szigorúbbak, és azt tartják, hogy a kicsiny, 1 cm alatti tumoroktól eltekintve az összes GIST rosszindulatú. A lokalizációt tekintve a gyomorból kiinduló tumorok prognózisa jobb, mint a vékonybélből kiindulóké. A GIST előfordulhat daganatos szindrómák részeként, pl. von Recklinghausen-betegségben, Carney-szindrómában (GIST + paraganglioma + tüdőchondroma).
III./2.3.4.: Az áttétképzés helyei
Elsősorban a máj érintett (kb. 30%), illetve a peritoneum, az áttétképzés módja többnyire haematogen. Nyirokcsomóáttéteket ritkán ad, ezért lymphadenectomiát a primaer tumor eltávolításakor nem szoktak végezni. Ugyancsak ritka tüdő-, illetve általában hasüregen kívüli áttétek képződése.
III./2.3.5.: Makroszkópos jellemzők
Ép, vagy másodlagosan kifekélyesedett (2. rajz) nyálkahártya-borítás alatt intramuralisan – submucosus, intramuscularis vagy subserosus helyzetben – általában körülírt, gömbölyded, rendszerint éles határú, metszlapon rostozott szerkezetű, szürkésfehér színű, tömött tapintatú tumorgöb van. A nagyobb daganatok közepe elhalhat, úgy, hogy vitális tumorszövet csupán a széleken, változóan vastag sávban marad meg csupán, s az így kialakuló, egyenetlen és necroticus belfelszínű üreg a tumornak tömlős jelleget kölcsönöz (3. makrokép). Ritkább, hogy a tumor többgócú, különösen a gyomor-, illetve az 1-es típusú neurofibromatosishoz (NF-I.) társuló vékonybél-GIST-ek lehetnek multinodularisak, de kifejezetten és jellemzően ilyenek a gyermekkori GIST-ek is.
|

Tekintse meg a képeket és elemezze a látottakat!
|
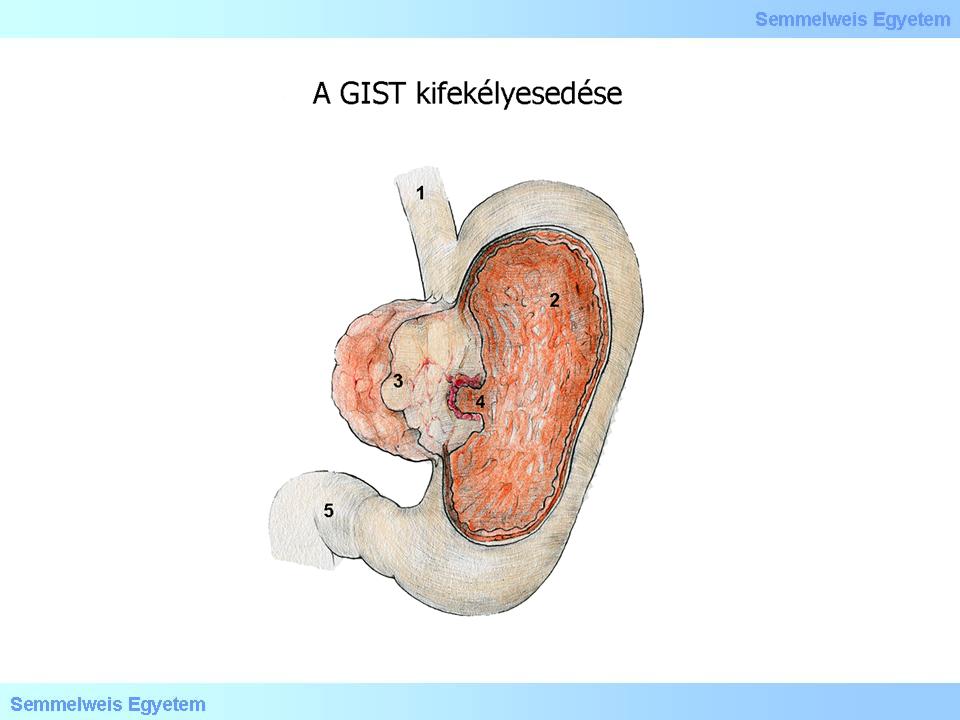
2. rajz: A GIST kifekélyesedése: (1) Oesophagus; (2) Ventriculus; (3) Tumor ( GIST ); (4) Ulceralt felszín; (5) Duodenum.
|
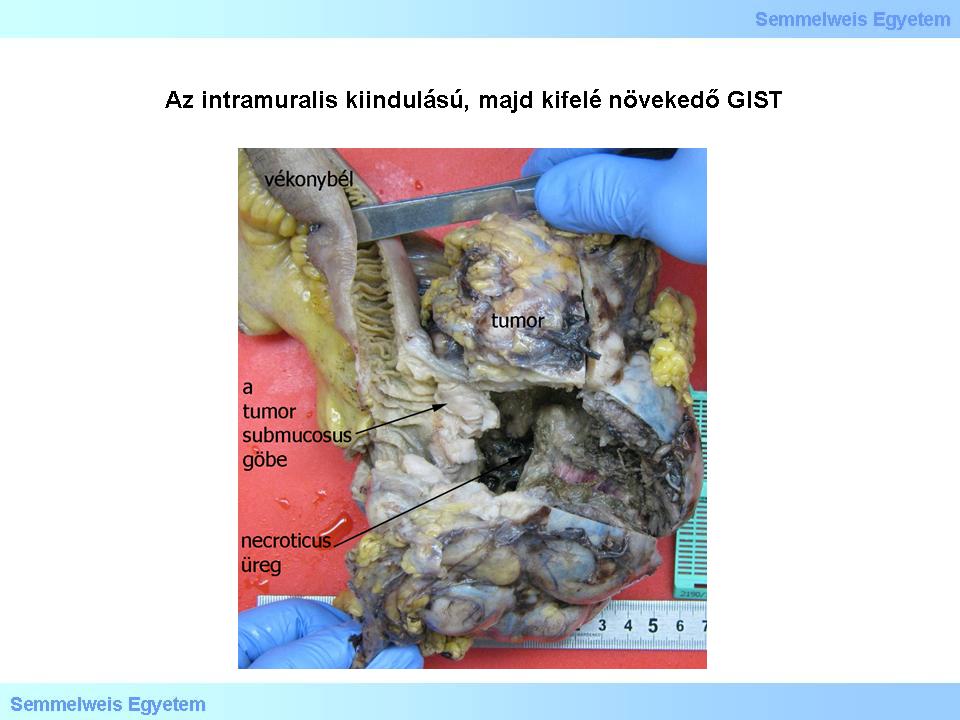
3. makrokép: Az intramuralis kiindulású, majd kifelé növekedő GIST közepe centrális tumornecrosis miatt hatalmas üreget tartalmaz. A daganattömeg körülírt, gömbölyded, éles határú, metszlapon a széli, vitális részeken szürkésfehér, tömött. A bemutatott esetben az ép nyálkahártya alatt közvetlenül daganatos göbök tűnnek fel.
|
III./2.3.6.: Mikroszkópos jellemzők
A legtöbb GIST három fő szöveti típus valamelyikét mutatja:
a leggyakoribb orsósejtes (spindle cell) (1. és 2. mikroképek),
a szélesebb sejttestű epithelioid (3. mikrokép), illetve
a kevert orsó- és epithelioid típus.
Ezen kívül ritkább szöveti variánsokat is leírnak, mint pl. a pleomorph [, vagy az óriássejtes forma. A tumor közepesen vagy kifejezetten sejtdús, a sejtek kötegekbe rendeződnek. Az osztódó alakok változó gyakoriak, az aggresszív viselkedésű tumorokban emelkedett osztódási aktivitás tapasztalható, olyannyira, hogy a mitózisszám a kockázatbecslés legfontosabb tényezője. A ritka szöveti formák közül a pleiomorph vagy óriássejtes szövettípusú GIST-ek legtöbbször PDGFRA-gén mutánsok, illetve a kifejezett anaplasiát mutató ún. dedifferenciált GIST-ek ritka eseteiben mind a KIT-, mind a PDGFRA-gén mutációjának hiányát tapasztalták.
|

Tekintse meg a képeket!
|
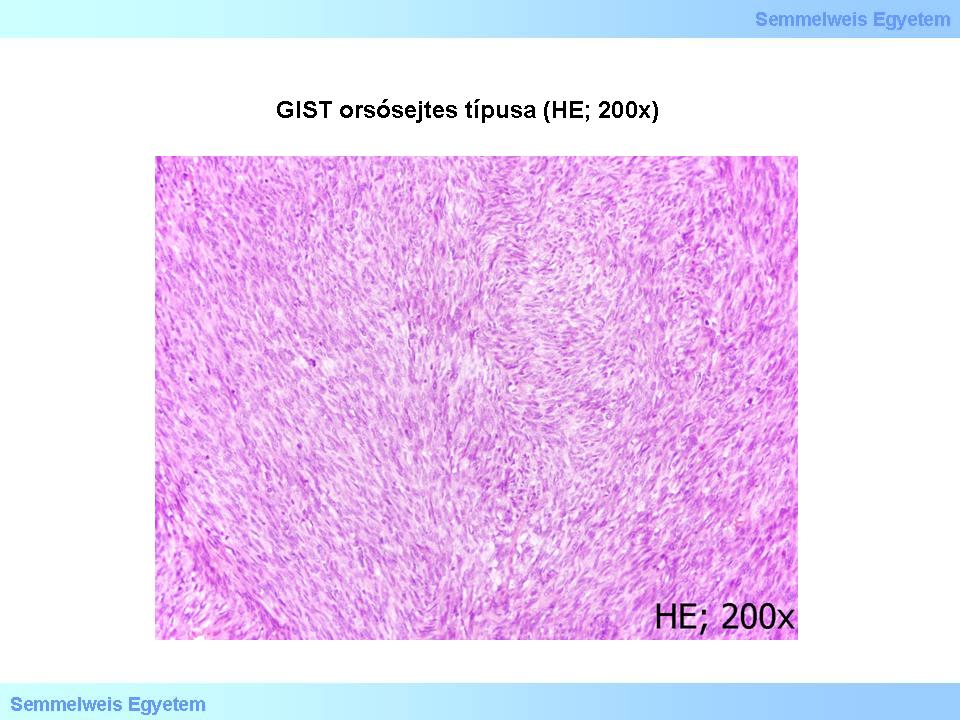
1. mikrokép: GIST orsósejtes típusa (HE; 200x). A daganat sejtdús, a sejtek kötegekbe rendeződnek.
|
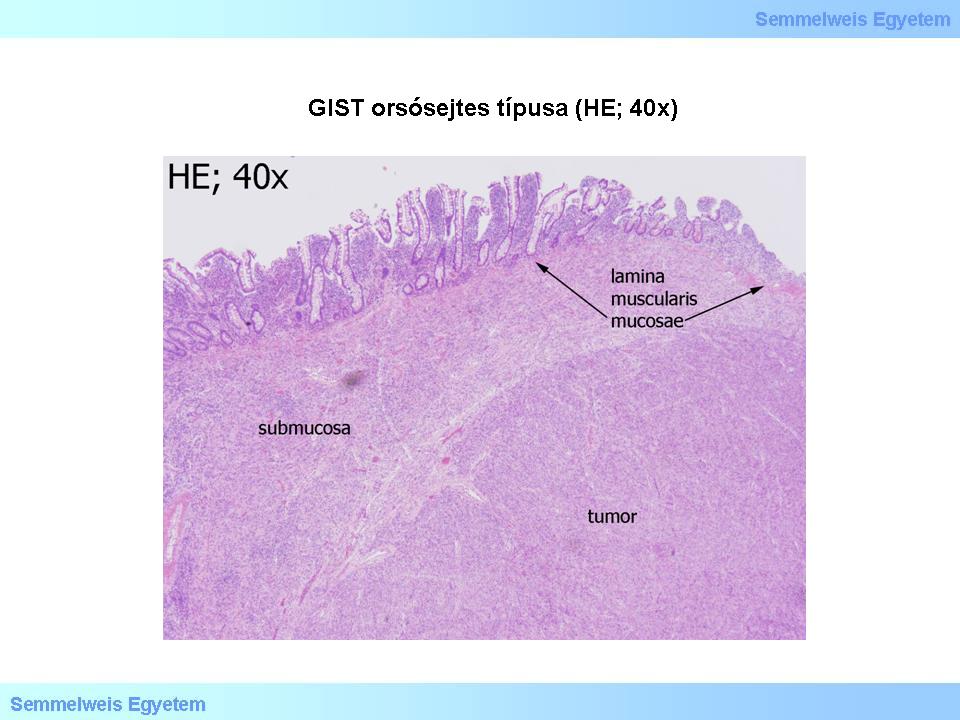
2. mikrokép: GIST orsósejtes típusa (HE; 40x). A daganat felett megtartott vékonybél-nyálkahártya van.
|
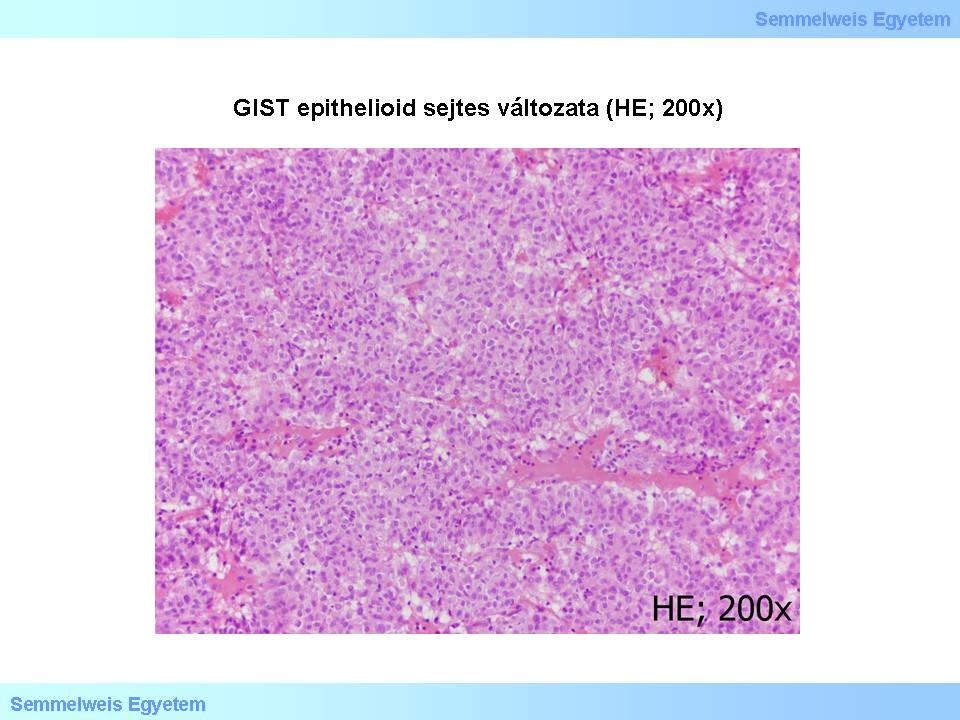
3. mikrokép: GIST epithelioid sejtes változata (HE; 200x). A sejtdús daganatot alkotó sejtek kerekdedek-tojásdadok, sejttestük viszonylag széles, sejthatáraik egyértelműek.
|
Az orsósejtes GIST-ek az esetek 70%-ában fordulnak elő. A rövid kötegekbe, örvényekbe rendezett sejtek közti stroma néhol myxoid megjelenésű, ritkán csontmetaplasiával. Esetenként a schwannomák Antoni-A típusú részeihez hasonló sejtelrendeződés (nuclear palisading) fordul elő. Vékonybél GIST-ekben gyakran látható a ’skenoid fibers’-ként ismert stromaelváltozás, amely megnyúlt, vaskosan rostszerű, élénken eosinophil, hyalinos-fibrillaris jellegű, feltűnő, extracelluláris collagen globulus struktúrákból áll. Az epitheioid GIST-ek aránya kb. 20%, a kevert szöveti típusé 10%.
III./2.3.7.: Immunreaktivitás
A c-kit/CD117 szinte mindig (85%) pozitív GIST-ekben, legyen az akár orsósejtes (4. mikrokép), akár epithelioid sejtes (5. mikrokép) szöveti variáns. A CD34 (többek közt hematopoeticus progenitor őssejt-, illetve endothelialis marker is) átlag 70%-ban pozitív: a gyomor-GIST-ek 80%-ában, a vékonybél-GIST-ek 50%-ában, a nyelőcső- és végbél-GIST-ek 95%-ában. A c-kit/CD117 egyébként még CD34-negatív GIST-en is pozitív lehet. A simaizom markerek (SMA, desmin) 20-40%-ban pozitívak, de az esetek kb. egyharmadában a c-kit/CD117 koexpresszálódik SMA-val (simaizom-actin). A myogen markerek értékelése egyébként külön figyelmet igényel, mert a szerv falának tumor által befogott izomrétegeiből (lamina muscularis mucosae, tunica muscularis propria) visszamaradt töredékek myogen kiérésű tumorrészletekként félreértelmezhetők.
|

Tekintse meg a képeket!
|
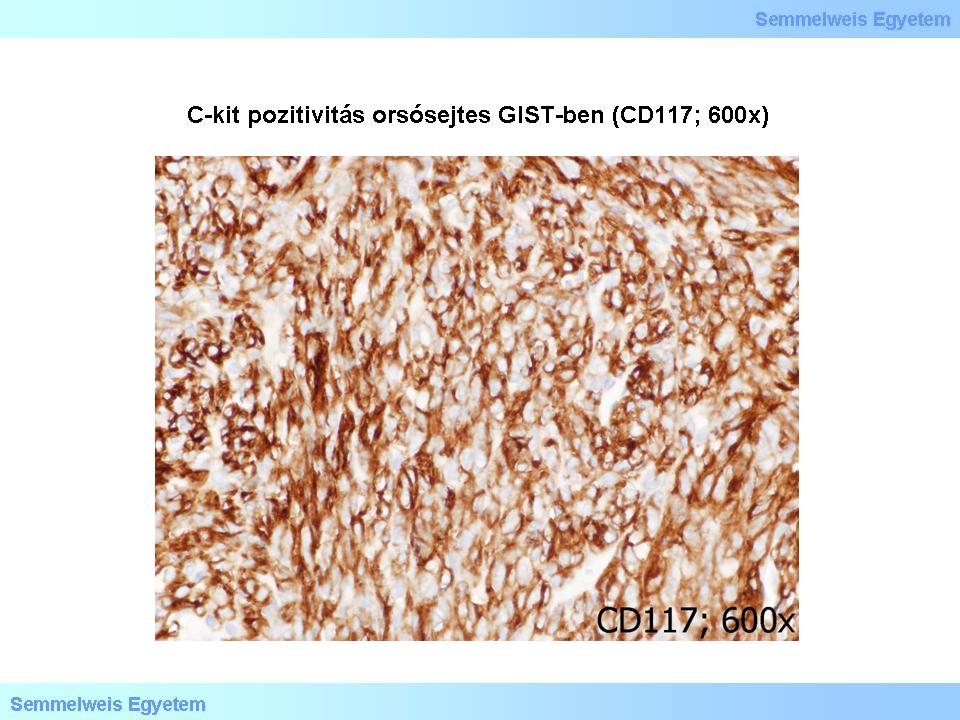
4. mikrokép: C-kit pozitivitás orsósejtes GIST-ben (CD117; 600x).
|
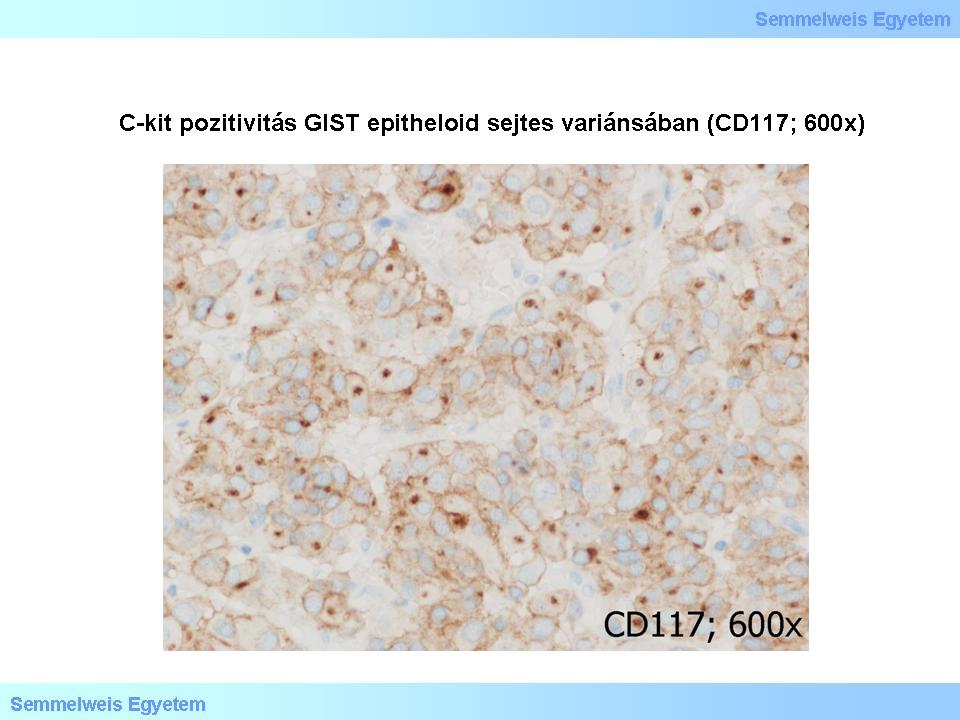
5. mikrokép: C-kit pozitivitás GIST epitheloid sejtes variánsában (CD117; 600x).
|
Újabban felismert GIST-specifikus markerek még a protein-kináz C-theta (PKCθ – ld. alább) és a DOG1. Utóbbit az FLJ10261 gén kódolja, ennek terméke a DOG1 nevű klorid-csatorna protein. Ez pozitív reakcióval jelöl olyan normál struktúrákat is, mint a Cajal-sejtek, illetve a gyomor nyálkahártya felszíni sejtjei. GIST-ekre a DOG1 kifejezetten specificikusnak mutatkozik, függetlenül a daganat KIT-, illetve PDGFRA- (ld. alább) mutációs státuszától. A DOG1 GIST-szenzitivitása a c-kit-ével azonosan magas. DOG1-pozitivitás tapasztalható extragastrointestinalis és metastaticus GIST-ekben egyaránt. Összefoglalva: a c-kit/CD117-, CD34-, protein-kináz C-theta- és DOG1 markerek olyan immunhisztokémiai panelt alkotnak, amely megfelelő segítség e daganatok azonosítására (6. mikrokép).
|

Tekintse meg a képeket és elemezze a látottakat!
|
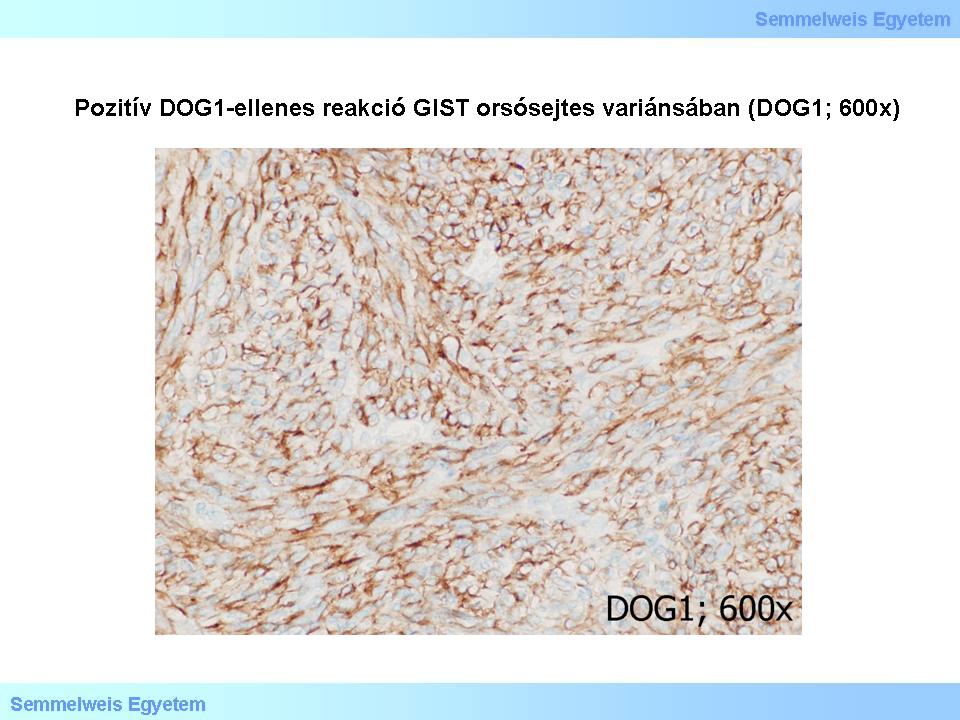
6. mikrokép: Pozitív DOG1-ellenes reakció GIST orsósejtes variánsában (DOG1; 600x).
|
III./2.3.8.: Hisztogenezis, tumorfejlődés, precursorlaesiók
Korábban simaizom, vagy idegszövet eredetűnek gondolták, diagnosztikus nevezéktanában is a leiomyoma, leiomyosarcoma, schwannoma, neurofibroma szerepelt. Ez ma már nem tartható. Jelenleg némely források mesenchymalis pluripotens progenitor sejtből származtatják, más szerzők e kiinduló sejtfajtát pontosabban a Cajal-féle interstitialis sejtekben, vagy azok előalakjaiban határozzák meg. (Az előbbi lehetőséget valószínűsítik az extragastrointestinalis GIST-ek ritka esetei.) A GIST egyik speciális formája lehet az ún. GANT (gastrointestinal autonome nerve tumor).
Csírasejtes (germline) KIT-, PDGFRA-, vagy NF1-génmutációt hordozó betegekben gyakorta jelen vannak önmagukban mikroszkópikus, c-kit/CD117-pozitív orsósejtes hyperplasiás gócocskák, de genetikai háttér nélkül is, az egyéb okokból elvégzett gastroesophagealis resectiók anyagában 10-30%-ban véletlen leletként (mintegy mini-incidentalomaként) kimutathatók. Ugyancsak fellelhetők sporadikus GIST-ek környezetében. E gócokat váltakozva nevezik ’sporadikus Cajal-sejtes hyperplasiá’-nak, ’mikroszkópikus GIST’-nek, ’GIST-tumorlet’-nek, ’seedling-GIST’-nek (GIST-hajtás). Az ilyen mini-incidentalomák 85%-ában KIT-mutáció van jelen, statisztikai elemzések szerint azonban kevesebb, mint 1%-ukból lesz klinikai jelentőségű GIST.
Az apró, incidentalis GIST-szerű laesiókban jelentkező szöveti degeneratív jelek (hyalinisatio, dystrophiás calcificatio) is arra utalnak, hogy növekedési potenciáljuk ezen morphologiai és genetikai állapotban korlátozott. Valódi tumorrá fejlődésükhöz nyilvánvalóan további géneltérések halmozódása szükséges. Cytogenetikai és összehasonlító genom-hybridisatiós tanulmányok szerint a GIST biológiai progressziójához vezet a halmozódó 1p-deléció, 8p-gain, 9p-deléció, 11q-deléció, 14q-deléció, 17q-gain, 22q-deléció. A 9p-deléciót különösen az aggresszív klinikai viselkedéssel hozzák összefüggésbe, és ez az elváltozás felelős a több más gyomor-bélhuzami mesenchymalis malignomában is kimutatható CDKN2A (p16INK4A) tumor suppressor gén inaktivációért is. Az 5p-, 20q-, 8q- és 17q-gain szintén aggresszív tumoros viselkedéssel, különösen az áttétképző hajlam növekedésével jár.
III./2.3.9.: Molekulárgenetikai háttér
|
 |
Az esetek számottevő hányadában a c-kit/CD117 fehérje pozitivitás hátterében a KIT-gén (avagy az ehhez igen hasonló PDGFRA-gén, ld. alább) aktiváló mutációja kimutatható, így korábban azt gondolták, hogy ez obligát összefüggésként magyarázza a fehérje-expressziós phenotypust. Ma már tudjuk, hogy a helyzet nem ilyen egyszerű, és nemcsak a génmutáns esetek c-kit/CD117-pozitívak, hanem a mutáció nélküli ún. vad típus (wild-type KIT, WT-KIT) is az lehet, sőt ellenkezőleg, a c-kit/CD117-negatív tumorban is lehet mutáció (mind a KIT-, mind a PDGFRA-génben). Emiatt c-kit/CD117-negatív tumorok esetén, diagnosztikus segítségként, javasolt a mutációs státusz vizsgálata. A szindróma-asszociált (1. típusú neurofibromatosis, Carney-szindróma, stb.) és a gyermekkori GIST esetek (ld. ott) is lehetnek c-kit/CD117-pozitívak, pedig KIT- és PDGFRA-génjük ép. Az onkogenezis oka ezekben az esetekben még nem ismert.
A KIT proto-onkogén a 4-es kromoszóma hosszú karján helyezkedik el, és kódolja a c-kit/CD117 nevű transzmembrán tirozinkináz-receptort. Sporadikus GIST-ekben e gén elsősorban a 11-es, ritkábban a 9-es, a 13-as és a 17-es exonjaiban szenved mutációs károsodást. A leggyakoribb (65%) a 11-es exon mutációja, amely a receptor juxtamembrán doménjét kódolja. Mutációi leginkább in-frame deléciók, amelyek némelyike (pl. az 557–558-as kodonoké) kedvezőtlen lefolyással párosulnak. További mutációs változatok: deléció/insertio: 557, 559, pontmutáció: 557, 559, 560, 576, amelyek főleg gyomor-GIST-ekben társulnak jobb prognózissal, vékonybél-GIST-eknél ilyen összefüggés nincs.
Ritkábban (9%) a receptor extracellularis doménjét kódoló 9-es exon érintett, amely lényegében minden esetben egy hat nukleotidból álló, alanint és tirozint kódoló szakasz duplikációját jelenti (duplikáció/insertio: AV501-502, FAF506-508). Ez a mutációs környezet főleg vékonybél-GIST-ekben fordul elő, és kedvezőtlen prognózissal társul. A 13-as exon pontmutációja (642) a receptor TK-I ATP-kötő zsebét, míg a 17-es exon pontmutációja (816, 822) a TK-II aktivációs kacsot érinti – e két exon mutációja ritka (<1-2%). Igen ritkán a 8-as, 12-es, 14-es, 18-as exonok mutációja is előfordulhat. A mutációk folytán szerkezetileg (konstitutíve) aktivált állapotú c-kit/CD117-receptor jön létre, amely ezután már ligand nélkül is serkenti a GIST-sejteket, gátolja apoptosisukat.
A juxtamembrán domén pl. egészséges állapotban gátolja a receptort; ez a gátlás megszűnik, ha a 11-es exon hibája miatt aminosavcsere történik, vagy ez a rész elvész, és ligandfüggetlen constitutiv, állandósult aktiváltság jön létre. A c-kit/CD117-receptor élettani ligandja az őssejtfaktor (stem-cell factor – SCF), innen a KIT-gén által kódolt transzmembrán tirozinkináz-receptorra a SCF-receptor elnevezés. A mutált receptor ellen iparilag előállított specifikus antitest a receptor immunhisztokémiai kimutatását teszi lehetővé közvetlenül a tumorból származó szövettani metszetpreparátumon, azaz a receptor mutációja diagnosztikus célpontot jelent. Ugyanez az immunhisztokémiai reakció azonban pozitív a mutációt nem mutató, vad típusú tumoron (WT-GIST, ld. alább) is, illetve a reakció endogén kontrolljaként használható, hogy ugyancsak pozitív a Cajal-sejteken, sőt hízósejteken is.
A c-kit/CD117-negatív GIST-ekben pathogenetikai jelentőséghez jutó PDGFRA-génben amely a KIT-hez hasonlóan a 4-es kromoszóma hosszú karján helyezkedik el, és terméke ugyanúgy III. típusú transzembrán tirozinkináz receptor protein – pontmutációk vannak a 12-es, 14-es és 18-as exonban, főleg gyomor-GIST-ekben. A 18-as exon deletioja a leggyakoribb (kb. 6%), és imatinib-resistentiát eredményez. A 12-es exon mutációja a ligandkötő domén elvesztését okozza, és imatinib-érzékenységgel jár. A PDGFRA-mutált GIST-ek igen gyakran gyomor- vagy extraabdominalis helyzetűek, szövettani megjelenésükben gyakori az epithelioid phenotypus, a myxoid stroma, a többmagvú óriássejtek jelenléte.
Más, járulékos kromoszóma deléciója is előfordulhat, és ez összefügg a tumorprogresszióval; ilyen pl. a 14. kromoszóma monoszómiája és a 22. kromoszóma vesztése.
|
 |
Összességében, aktiváló mutációk a GIST-esetek 90%-ában fordulnak elő; 85%-ukban KIT-, 5%-ukban PDGFRA-gén mutáció, 10%-ban nincs jelenleg azonosítható mutáció. A KIT- és a PDGFRA-gén mutációk egymást kölcsönösen kizárják. A KIT- és PDGFRA-gén mutációra negatív eseteket KIT/PDGFRA-vad típusú GIST-eknek (wild type GIST-ek, WT-GIST) nevezik, amelyekben legújabban a 15-ös exon BRAF V600E mutációját detektálták felnőttekben.
III./2.3.10.: Az ún. c-kit/CD117-negatív GIST-ek csoportja
Bár a c-kit/CD117-receptor-tirozinkináz expresszió a tumor besorolásának legfontosabb pillére, mégis létezik egy olyan, a GIST klinikai és morphologiai kritériumait mindenben kielégítő csoport (az összes GIST-esetek 10-15%-a), amely c-kit/CD117-negatív. E tumorok gyakran gyomor, cseplesz-, illetve retroperitonealis eredetűek, de a c-kit/CD117-pozitív esetekhez hasonlóan voltaképp a gyomor-bélhuzam bármely szakaszán kialakulhatnak, szöveti spektrumuk szerint is hasonlók: epithelioid sejtestől az orsósejtes variánson át az anaplasticusig bármely szöveti forma megjelenhet, esetenként CD34-, vagy SMA-pozitivitást is mutathatnak. A c-kit/CD117-negatív esetek egy hányadában (kb. 35%-ában) kimutathatók viszont a PDGFRA-gén alteratioi: 18-as exonjának mutációja, a géntermék Asp→Val842 missense substitutioja és DIM842–844 aminosav deletio.
A c-kit/CD117-negatív esetek kimutatásában jelentős segítséget nyújthat továbbá a protein-kináz C-theta (PKCθ), a protein-kinázok serin/threonin-családjába tartozó, a Cajal-féle interstitialis sejtekben és GIST-ekben egyaránt aktivált fehérje, amely GIST-ben szerkezetileg foszforilált állapotú, függetlenül a KIT-gén mutációs státuszától és a c-kit/CD117-immunreaktivitástól. Ezek szerint a c-kit/CD117-negatív GIST-eknek létezik egy alcsoportja, amelyben a c-kit/CD117-pozitív tumorokkal fennálló kliniko-pathologiai azonosságot intragén PDGFRA-aktiváló mutációkkal lehet magyarázni, míg a maradék c-kit/CD117-negatív tumoranyagban a kórfejlődést magyarázó daganatképző (onkogén) folyamatokat és az ezek eredményeképp keletkező kliniko-pathologiai azonosságokat ma még nem tudjuk megindokolni. Mindenesetre a PDGFRA-génmutáns, c-kit/CD117-negatív GIST-ekben a c-kit/CD117-expressio akár a kimutathatóság küszöbét el nem érően alacsony is lehet.
III./2.3.11.: Elkülönítő kórisme
|
 |
Ebből a szempontból fontosak a leiomyomák, leiomyosarcomák (ezek desmin- és actin-pozitívak) és a schwannomák (ezek S100-protein-pozitívak), amelyek mind gyomor-bélhuzami, mind ezen kívüli helyekről származó eseteikben következetesen c-kit/CD117-negatívak. Solitaer fibrosus tumorok és a Kaposi-sarcoma, egyébként jellegzetesen CD34-pozitív elváltozások, szintén következetesen c-kit/CD117-negatívak. Olyan CD34-pozitív daganatok közül, amelyek ritka, esetenkénti c-kit/CD117-reaktivitást mutathatnak, megemlítendő a dermatofibrosarcoma protuberans és a hemangiopericytoma. Ritkán, változó erősségű c-kit/CD117-pozitivitást mutatható mesenchymalis daganatok között szerepel a világossejtes sarcoma, áttétes melanoma malignum és a malignus fibrosus histiocytoma, de a csírasejtes tumorok közül a seminoma/dysgerminoma is pozitív c-kit/CD117-re.
További nehézség lehet egyéb mesenchymalis entitások elkülönítése, mint amilyenek pl. az abdominalis fibromatosisok, a gyulladásos myofibroblastos tumor (inflammatory myofibroblastic tumor), vagy a gyulladásos fibroid polyp (inflammatory fibroid polyp). A gyulladásos fibroid polypban az utóbbi időben ugyanolyan PDGFRA-gén mutációkat írtak le, mint amilyeneket a GIST-ekben ismerünk. Epitheioid GIST-től való elkülönítés okozhat gondot epitheioid melanoma, carcinoma, glomus tumor, seminoma, világossejtes carcinoma esetén. Különös feladat elé állítja a diagnosztát a c-kit/CD117-negatív GIST-ek csoportja, amelyek esetenként egyidejű CD34-, vagy SMA-pozitivitást is mutathatnak, hisz ezeket épp nem elkülöníteni kell a GIST-ektől, hanem hozzájuk sorolni.
III./2.3.12.: Familiaris GIST és egyéb GIST-szindrómák
|
 |
A GIST egyes esetekbeni családi halmozódását Nishida és mtsai. 1998-ban írták le. Az ilyen tumorok mutációit a sporadikus GIST-ekével azonosnak találták. Az öröklésmenet autosomalis domináns, és az ilyen családok érintett tagjaiban a sporadikus GIST-ekre jellemző életkornál fiatalabb korban akár több GIST is fejlődhet, és e jelenséget egyéb elváltozások kísérhetik: perinealis hyperpigmentáció, pigmentnaevusok nagy száma, hízósejtes rendellenességek (urticaria pigmentosa, systemás mastocytosis). Bár a familiaris GIST a sporadikustól morphologiailag megkülönböztethetetlen, egyes szerzők mégis feltételezik, hogy – ellentétben a sporadikus változattal – az ilyen tumorok hordozói a primaer tumor méretétől és osztódási aktivitásától függetlenül az áttétek kialakulásának fokozott veszélyének vannak kitéve, ezért a familiaris GIST-es családok veszélyeztetett tagjainak fokozott és állandó követését javasolják.
Jelenleg három szindrómáról tudjuk, hogy hajlamosít akár egyszerre több GIST képződésére:
-
- a Carney-triász,
-
- a Carney-Stratakis szindróma és
-
- az 1. típusú neurofibromatosis (NF-I.).
A Carney-triász gyomor-GIST, paraganglioma és tüdő chondroma együtteséből áll, főleg fiatal nőkben. Az ilyen GIST-ek pathologiailag és klinikailag eltérnek a sporadikus változatúaktól, jellemzően lassabban fejlődnek, epithelioid szöveti megjelenésűek, az áttétképzés magasabb kockázatával járnak, és áttéteiket különösen nyirokcsomókba adják. Eddig sem KIT-, sem PDGFRA-gén mutációt nem mutattak ki ezen daganatokban. A Carney-triász-asszociált GIST-ek kialakulását jelenleg somaticus mutációval magyarázzák, azaz az onkogenezist sporadikus típusúnak tartják, ennek ellenére a sporadikus GIST-ekben alkalmazott imatinib (Glivec) terápiára e tumorok nem, vagy nem egyértelműen reagálnak, és a hagyományos kockázatbecslő sémák sem megbízhatóak a klinikai fejlemények kórjóslására.
A Carney-Stratakis szindrómában jelentkező GIST-ek a succinate dehydrogenase (SDH) SDHB, SDHC vagy SDHD alegységének csírasejtes (germline) mutációja révén öröklődő. A szindróma klinikailag multifocalis GIST-ek, paragangliomák és pheochromocytoma együtteséből áll. A Carney-Stratakis szindróma-asszociált GIST-ek főként a gyomorban fordulnak elő, szövetileg döntően epithelioid megjelenésűek.
1. típusú neurofibromatosisban (NF-I.) szenvedő betegek kb. 7%-ában multiplex GIST-ek jelentkezhetnek az NF1-gén csírasejtes (germline) mutációja révén. E gén a GTP-áz aktiváló neurofibromin fehérjét kódolja. Az NF1-asszociált GIST-ek jellemzően többszörös, kis tumorokként jelentkeznek a vékonybelek falában, szövetileg orsósejtes variánsúak, tele skenoid rostokkal. E tumorok legtöbbjében nincs sem KIT-, sem PDGFRA-gén mutáció, klinikailag rendszerint indolens viselkedésűek.
III./2.3.13.: Gyermekkori GIST
|
 |
Ezek a GIST-ek a második életévtizedben jelentkeznek, átlagban 13-14,5 éves korban. A nemek közti megoszlásban kifejezett női dominancia tapasztalható. A megjelenés helye döntően a gyomor, a gyakran multifokális tumorok szövetileg jellemzően epithelioid típusúak. Bár egységesen termelnek c-kit/CD117-fehérjét, csak ritkán tartalmaznak KIT-, vagy PDGFRA-gén mutációt. A szöveti és klinikai jellemzők meglepően egybeesnek a Carney-triász-asszociált GIST-ekéivel, s valóban, a betegek egy részében valódi Carney-triász van jelen, s ezért bármely, gyermekben felfedezett GIST esetén indokoltak a Carney-triász ellenőrzésére végzett vizsgálatok. A felnőttek tumoraira használatos kockázatbecslő sémák nem érvényesek a gyermekkori daganatok viselkedésének kórjóslására, ezek ugyanis, még ha áttéteket képeznek is, általában kedvező kórlefolyást mutatnak: a tumormentes 5 éves túlélés kb. 70%, a tumoros túlélés kb. 20%, a daganatos halálozás kb. 10%.
III./2.3.14.: Az elsődleges GIST-ek kockázatelemzése (ún. risk stratification)
A jelenlegi ajánlások szerint elsődleges sporadikus GIST-ek kockázati analízisét három adat alapján kell elvégezni:
-
1) a mitoticus index,
-
2) a tumor mérete és
-
3) anatómiai megjelenési helye alapján (1. táblázat).
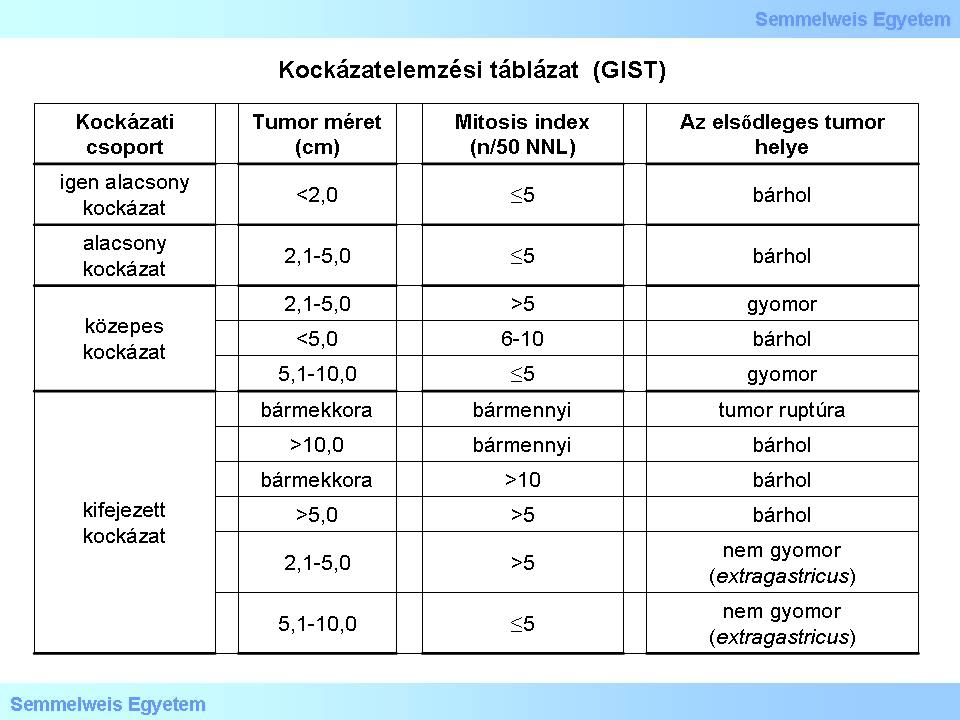
1. táblázat: Kockázatelemzési táblázat az National Institutes of Health (NIH) adatai alapján. (Joensuu H: Risk stratification of patients diagnosed with gastrointestinal stromal tumor. Human Pathol 2008, 39: 1411-1419.)
|
-
1) Az osztódási (mitoticus) aktivitás messze a legfontosabb prognosztikus faktor, értékét a tumor 5 mm2-ére vetített osztódások száma szerint kell megadni (ez régebbi mikroszkópok esetén 50 nagy nagyítású látótérnek /NNL; angolul high power field, HPF/, a modern, széles panorámájú mikroszkópokban 20-25 NNL-nek felel meg).
-
2) A tumorméret cm-ben adandó meg, szerepe a kórjóslásban azon alapszik, hogy nagyobb GIST-ek kórlefolyása rosszabb, mint a kisebbeké.
-
3) Az anatómiai lokalizáció jelentősége tapasztalati alapú: a gyomor-GIST-ek rendszerint indolensebbek, mint a bármely más (extragastricus) helyen keletkezőké.
E három tényező összhatását a következő kritériumrendszer mutatja:
-
- az áttétképzés veszélye alacsony azon gyomor-GIST-ben, amelyik nem nagyobb, mint 10 cm, és 5 mm2-enként 5 mitosisnál nem több számlálható benne;
-
- az áttétképzés veszélye magas azon gyomor-GIST-ben, amelyik nagyobb, mint 5 cm, és 5 mm2-enként 5 mitosisnál több számlálható benne;
-
- az áttétképzés veszélye legalább közepes mindazon bél-GIST-ekben, amelyek nagyobbak, mint 5 cm, függetlenül az osztódási aktivitástól;
-
- az áttétképzés veszélye magas mindazon bél-GIST-ekben, amelyekben 5 mm2-enként 5 mitosisnál több számlálható;
-
- az áttétképzés veszélye alacsony mindazon bél-GIST-ekben, amelyek nem nagyobbak, mint 5 cm, és 5 mm2-enként 5 mitosisnál nem több számlálható benne.
A College of American Pathologists (CAP) – sok más daganathoz hasonlóan – a GIST-ek számára is elkészített egy, a mindennapi leletezési gyakorlatot segíteni és egységesíteni hivatott listaszerű leletformátumot (checklist). Ebben sorra megadandók a tumoreltávolítás módja, a tumor anatómiai helye, mérete, egy- vagy többgócúsága, szövettani típusa, osztódási aktivitása, elhalt tumorrészeinek aránya, szöveti kiérésének foka (differenciáltság, grade), kockázatelemzésének eredménye, a kimetszési szélek tumoros/tumormentes állapota, kiegészítő (immunohistochemiai, molekulárgenetikai) vizsgálatok eredményei.
III./2.3.15.: Terápiás vonatkozások
A primer, lokalizált daganat sebészi eltávolítása az esetek 85%-ában sikeres. A kiújulás aránya és az 5 éves túlélés egyaránt 50% körüli.
|
 |
A KIT mutációja a tirozinkináz-gátlók számára kezelési célpontként (terápiás target) szolgál. Ilyen szerek az imatinib mesylate és a sunitinib malate, amelyek kisméretű szintetikus molekulákként a tirozinkináz aktivitás szelektív gátlói azáltal, hogy a c-kit/CD117 és a PDGFRA ATP-kötő zsebeinek kompetitív gátlói. A receptorhoz kötődve mindketten stabilizálják azt annak inaktivizált állapotában, amivel megakadályozzák autofoszforilációs aktiválódásukat és a c-kit/CD117 jelátvitelt. Ilyen gátló hatás tapasztalható más, hasonló szerkezetű tirozinkináz-receptoroknál is, mint pl. a c-abl, PDGF.
Az imatinib mesylate-ból készült gyógyszerrel (Gleevec®, Glivec ®, korábban STI571) sikereket értek el a kezelésben. A szert a c-abl inhibiciójára használják krónikus myeloid leukaemiában (CML), a c-kit/CD117 gátlására GIST-ek kezelésében. A KIT-gén 9-es exonjának aktiváló mutációi imatinib-érzékenységet, a 17-es exon mutációi imatinib-resistentiát okoznak. Arra vonatkozóan még nem állnak rendelkezésre adatok, hogy egyéb, erős c-kit/CD117-positivitást mutató, solid tumorok (mint pl. az adenoid cysticus carcinoma, seminoma, kissejtes tüdőrák) a tirozinkináz-gátló kezelésnek van-e hatása. Eleddig a szelektív tirozinkináz-gátló kezelésre a beteg-beválasztás feltétele a daganatból származó szövetminta c-kit/CD117-pozitivitása volt. Mivel azonban a gátlás a PDGFRA-tirozinkináz esetében is érvényesül, ezért a c-kit/CD117-negatív PDGFRA-gén mutáns GIST-ek is potenciális célpontjai lehetnek a Glivec-kezelésnek.
Az imatinibbel kezelt GIST-ek kb. felében két éven belül a szerrel szembeni rezisztencia alakul ki. Ennek morphologiai jele, hogy a tumorban új nodulusok képződnek, s ez képalkotókkal (CT) is látható. A rezisztenciát primér és szekundér rezisztenciaként osztályozzák. Primér gyógyszerrezisztenciának nevezik azt, amikor a tumorgóc(ok) mérete nem állandósodik, illetve csökken az első 6 hónap folyamán. Ez leginkább a KIT-gén 9-es exonjának, illetve a PDGFRA-gén 18-as exonjának mutációiban, illetve vad-típusú KIT esetében fordul elő. E betegek mutációs státusza az imatinib-kezelés előtt és után azonos, új mutációk nem keletkeznek.
Szekundér rezisztenciáról beszélnek, ha az imatinib kezelés első 6 hónapjában elért tumor stabilizációt vagy csökkenést azután tumor progresszió követi, ilyenkor általában a KIT-, illetve a PDGFRA-gének új mutációi alakulnak ki. ’Polyclonalis rezisztenciá’-nak nevezik azt, amikor különböző rezisztens nodulusokban eltérő új mutációk lépnek fel, amelyek önmagukban mind kezelési rezisztenciát okoznak.
|
|