| |
I./2.4.: Májdaganatok
|
 |
I./2.4.1.: A gócos májelváltozások osztályozása
I./2.4.1.1.: Elsődleges májdaganatok
I./2.4.1.1.1.: Jóindulatú hámeredetű daganatok
-
– hepatocellularis adenoma
-
– cholangiocellularis adeoma
I./2.4.1.1.2.: Rosszindulatú hámeredetű daganatok
-
– hepatocellularis carcinoma
-
– cholangiocellularis carcinoma
-
– kevert cholangio-hepatocellularis carcinoma
-
– hepatoblastoma
I./2.4.1.1.3.: Jóindulatú nem hámeredetű daganatok
-
– haemangioma cavernosum
-
– fibroma
-
– angiolipoma
I./2.4.1.1.4.: Rosszindulatú nem hámeredetű daganatok
– haemangiosarcoma
– haemangioendotheloma
– embrionalis sarcoma
– lymphoma
I./2.4.1.2.: Másodlagos (áttéti) májdaganatok
I./2.4.1.3.: Daganatszerű gócos májelváltozások
– focalis nodularis hyperplasia
– nodularis regenerativ hyperplasia
– mesenchymalis hamartoma
– cysták
– Echinococcus-cysta (1. makrokép)
– epeút eredetű (ún. biliaris) cysta
– hashártya eredetű (ún. inclusiós) cysta
– von Meyenburg-komplexum
– inflammatoricus pseudotumor
– májtályog
– infarctus
– peliosis hepatis
|

Tekintse meg az ábrát!
|

1. makrokep: Echinococcus-cysta. Az emberben, mint a féreg életciklusában köztigazdaként szereplő résztvevőben kialakuló, kötőszövetes tokkal határolt tömlő megrepedése anafilaxiás sokkot válthat ki. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Szirtes Ildikó gyűjtése)
|
I./2.4.2.: Hepatocellularis adenoma
|
 |
A májsejtekből kiinduló jóindulatú daganat, leggyakrabban fiatal nőkben. A daganatképződés a feltételezések szerint összefüggésben áll szájon át szedett fogamzásgátlók és androgen-steroidok használatával. Makroszkóposan unilocularis, éles határú, tokkal körülvett, változóan nagy, szabályos gömb alakú elváltozás, amelynek állománya a májéhoz hasonlóan egynemű, barnássárgás-barnásvörhenyes színű. A bevérzések, elhalások gyakoriak.
Szövetileg májsejtekre emlékeztető, polygonalis tumorsejtekből áll. A daganatszövet esetenként nagyszámú, szabálytalan lefutású érképletet tartalmaz, és minden esetben jellemzően hiányoznak a portalis terek és az epeutak. A májtok alatt elhelyezkedő adenomák veszélye a tumorruptura, vérzés és az ún. akut has szindróma. Elkülönítő kórisme (differenciáldiagnózis) szempontjából ez esetben egyéb, szintén akut has szindrómát okozható betegségek (nőbeteg esetén pl. méhkürtterhesség) jönnek szóba.
I./2.4.3.: Cholangiocellularis adenoma
Az epeutak hámjából kiinduló, jóindulatú daganat. A tumor makroszkóposan egyszeri vagy multiplex, szürkésfehér, tömött, rendszerint <1cm. Helyzete nem ritkán májtok alatti. Szövetileg abnormális, epeútszerű járatképletek látszanak, amelyeket epeúthámsejtekre emlékeztető, típusos köb- vagy hengerhám bélel, s amelyeket tömör, collagenrost-gazdag kötőszöveti stroma vesz körbe. Elkülönítő kórismeileg – különösen többgócú, májtok alatti cholangiocellularis adenoma esetén – carcinoma-áttétek (pl. pancreas carcinomából), avagy primer cholangiocellularis carcinoma, illetőleg biliaris hamartoma (von-Meyenburg-komplexum) jöhet szóba.
I./2.4.4.: Hepatocellularis carcinoma (HCC)
I./2.4.4.1.: Epidemiológia, patogenezis
|
 |
A máj leggyakoribb elsődleges rosszindulatú daganata. Az ötödik leggyakoribb rosszindulatú daganat a világon, és harmadik a daganatok okozta halálozási statisztikákban, jelentős földrajzi eltérésekkel. Kialakulását számos tényező befolyásolja, kóroki tényezői között szerepelnek a hepatotrop vírusinfekciók (HCV, HBV), az alkohol, az aflatoxin (gabonagomba), egyes gyógyszerek (pl. androgen steroidok), illetve az előfordulás esélyét növelik ritka, öröklődő anyagcserebetegségek, mint pl. a glycogentárolási betegségek bizonyos típusai, haemochromatosis, az alfa-1-antitripszin hiánya, tyrosinaemia, hypercitrullinaemia, porphyria cutanea tarda, öröklődő haemochromatosis (leggyakoribb mutációja a C287Y), Wilson-betegség, glycogenosis.
|
 |
Bizonyos földrajzi területeken (pl. Afrika, Távol-Kelet) endemiás HBV-fertőzések miatt igen gyakori a májrák, a vírus genomját mind a ráksejtekben, mind a nem rákos májsejtekben ki lehet mutatni. Igazolták, hogy a vírusok bizonyos termékei (pl. a HBV ún. X-génjének fehérjeterméke) elősegítik a malignus átalakulást. Az esetek többségében (70-80%) a hepatocellularis carcinomát cirrhosis előzi meg: ezen esetek túlnyomó részében hepatocyta-pusztulással (necrosis) járó károsodás szerepel előfutárként, és az állandó sejtpusztulással regeneratiót célzó proliferatio jár együtt, ám az eredeti viszonyok helyreállítása a súlyos szerkezeti torzulások miatt hiábavaló törekvés, s eközben megnő az esély a belső vagy külső okok miatti génhibák kialakulására.
Hyperplasticus, majd dysplasticus gócok jelennek meg, végül kialakul a malignus phenotípus, a hepatocellularis carcinoma. A daganat kialakulásában genetikai eltérések mutathatók ki, így a p53- és más szuppresszorgének mutációi, különböző növekedési faktorok fokozott expressziója. A HCC serologiai és immunhisztokémiai markere az alpha-foetoprotein (AFP), amely mind az első diagnozisnál, mind tumorrecidiváknál a betegkövetés fontos eszköze (AFP – élettani szövetmarker a magzati és újszülöttkorban, később azonban expressioja megszűnik, és újbóli megjelenése daganatképződésre utal. Más daganatok, mint pl. csírasejtes tumorok, pancreatoblastoma is lehetnek AFP+-ak).
I./2.4.4.2.: Alaktan (morphologia)
|
 |
Többféle makroszkópos megjelenési formája ismert.
-
- Az egyetlen soliter (nagyobb), rendszerint áltokkal határolt daganatgöb az ún. masszív forma.
-
- A több, változóan nagy daganatgöb az ún. nodularis forma.
-
- A számos apró, az állebenykéknek megfeleltethető méretű tumorgóc neve cirrhosis carcinomatosa, ez viszonylag ritka.
Jellemző még ún. satellitatumorok (fiókdaganatok) gyakran már makroszkóposan is egyértelmű kialakulása (2. makrokép), valamint a visszérrendszerbe való betörés. A daganat színe rendszerint barnás-zöldes, jól differenciált tumorok esetén epetermelésre képes, ezért mélyzöld vagy zöldes (3. makrokép), ritkábban szürkésfehér-vörhenyes (4. makrokép). Kiterjedt tumornecrosisok előfordulhatnak, ezt makroszkóposan felpuhulásként érzékeljük.
|

Tekintse meg és elemezze a képeken látottakat!
|
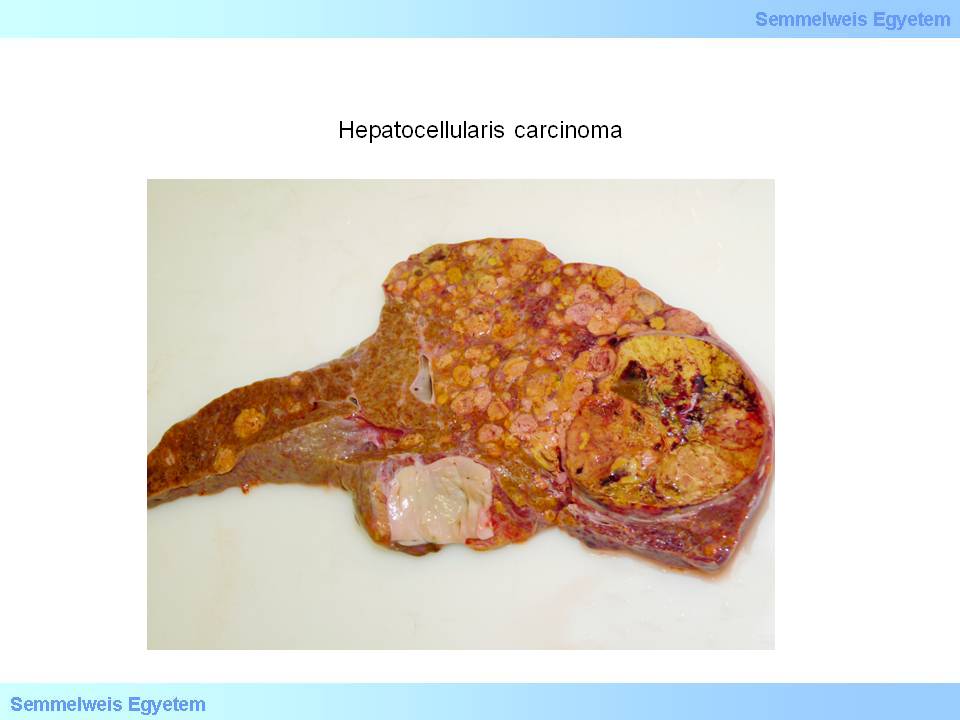
2. makrokép: Hepatocellularis carcinoma. Szoliter tumoros göb mellékén megjelenő ún. fiókdaganatok (tumorsatelliták). (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Szirtes Ildikó gyűjtése)
|
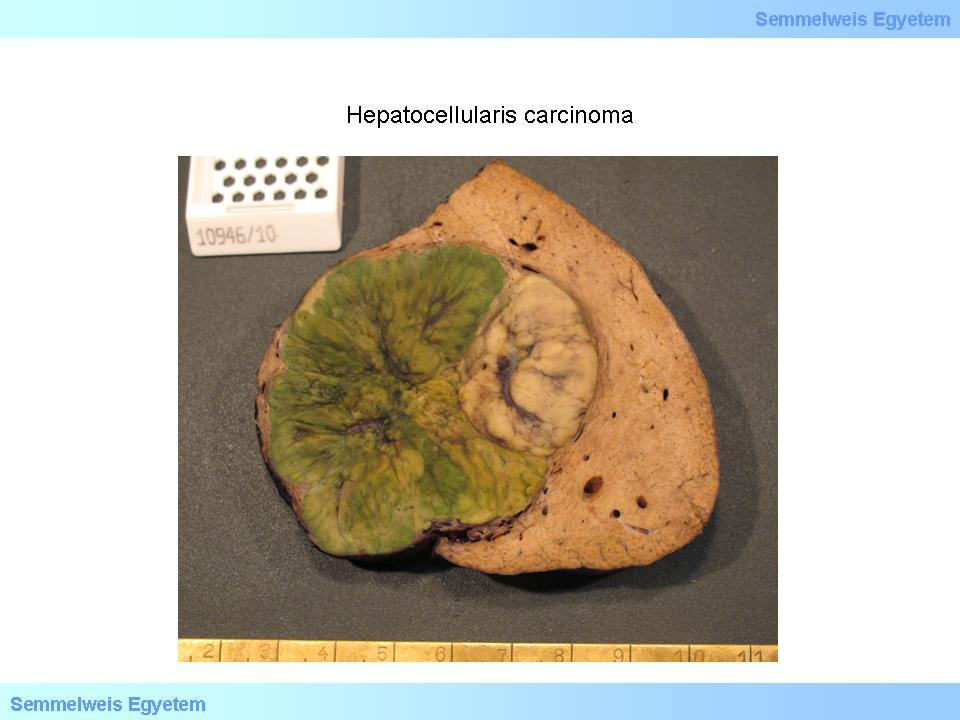
3. makrokép: Hepatocellularis carcinoma. A jól differenciált daganatok jellemző zöldes színe a tumorsejtek megtartott epetermeléséből adódik. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Szirtes Ildikó gyűjtése)
|
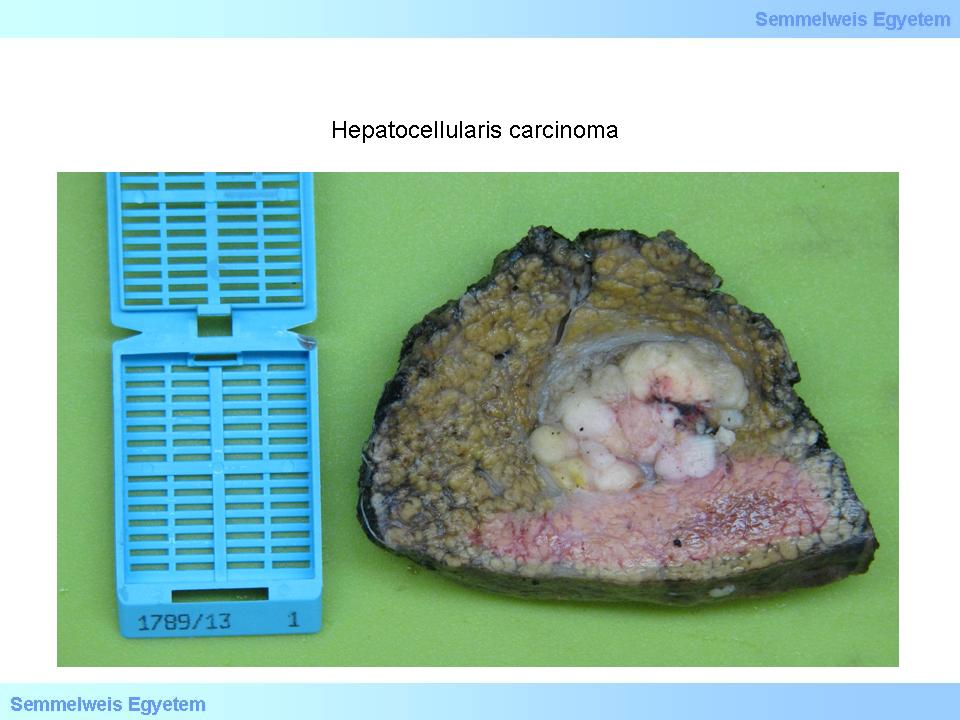
4. makrokép: Hepatocellularis carcinoma. Esetenként a daganatok a metasztatikus gócokra is jellemző szürkésfehér megjelenésűek. Itt a cirrhoticus környezet is sugallja a tumor elsődleges voltát, tekintve, hogy kórbonctani tapasztalat szerint cirrhoticus májban ritkán keletkezik áttét. Erre valószínűleg a portalis hypertensio szolgálhat magyarázatul, mivel a nehezített portalis beáramlás akadályozhatja a tumorsejtek bejutását a májba. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Szirtes Ildikó gyűjtése)
|
Szöveti szerkezet szerint a következő formák különíthetők el:
|
 |
-
- trabecularis,
-
- tubularis,
-
- alveolaris, illetve
-
- különleges formák (világossejtes, pleiomorph-anaplasticus, fibrosus).
A kiérés foka (differenciáltság, grading) szerint ismerünk jól differenciált (grade I.) daganatokat, amelyeket nehéz a májszövettől, illetve az adenomától elkülöníteni; a közepesen és alacsonyan differenciált (grade II-III.) tumorokat, amelyekben a szövetszerkezeti formák egyike-másika még felismerhető (3. és 4. mikroképek); és kiéretlen, differenciálatlan (grade IV.) daganatokat, amelyek súlyos kórsejttani eltéréseket tartalmaznak, a tumor eredete csak speciális vizsgálómódszerekkel bizonyítható. A „nodule in nodule” mintázat agresszív (high-grade) transformatiot jelez. A májráksejtek gyakran mutatnak α-1-antitripsin vagy alpha-foetoprotein (AFP)-positivitást.
|

Tekintse meg és elemezze a képeken látottakat!
|
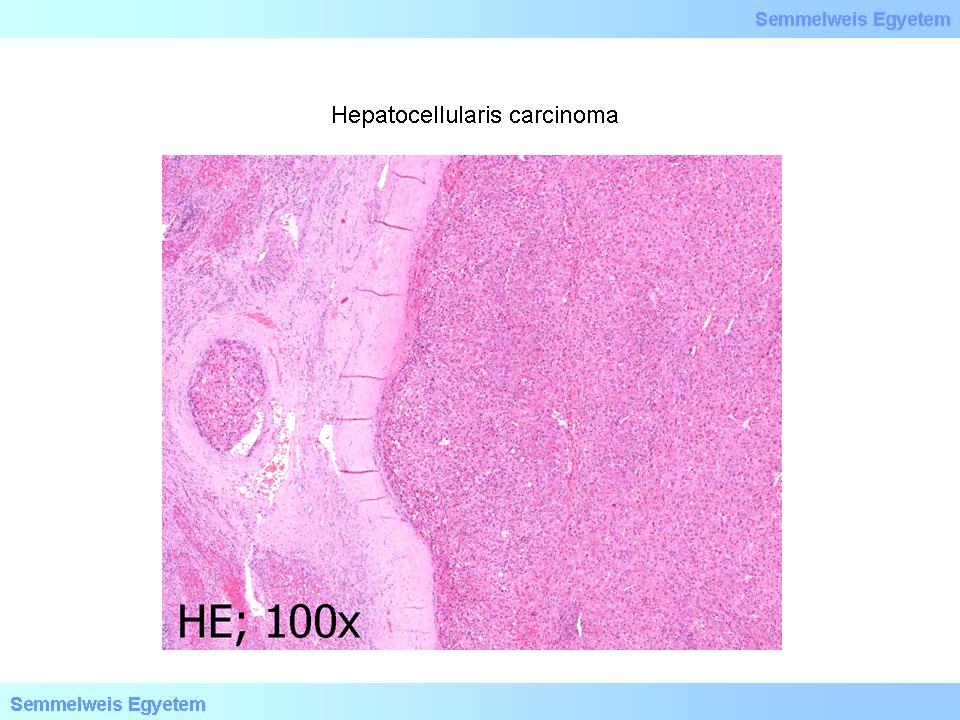
3. mikrokép: (HE; 100x) Hepatocellularis carcinoma. A környező májállománytól áltokkal (pseudocapsula) elhatárolódó elsődleges, májsejt-eredetű tumor góca látható. A kép bal oldalán egy kitágult vénában daganatos invasio jele. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képanyagából –Szirtes Ildikó gyűjtése)
|
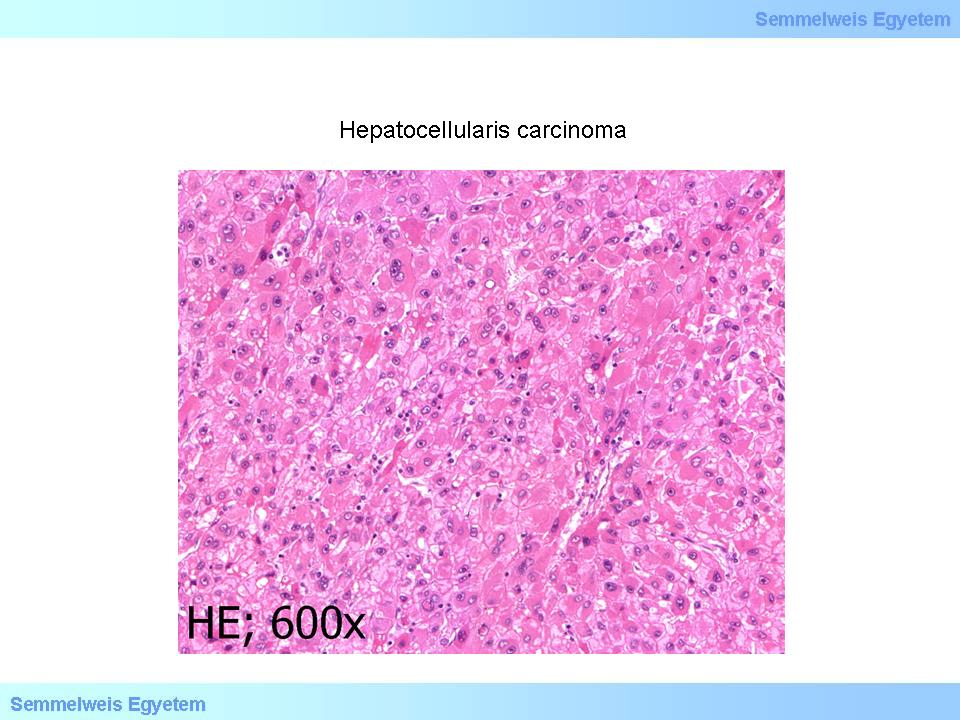
4. mikrokép: (HE; 600x) Hepatocellularis carcinoma. A 6P-3. mikroképen látott daganatszövetet – nagyobb nagyítással láthatóan – májsejtekre emlékeztető, megnagyobbodott magvú, prominens nucleolust tartalmazó, közepesen polymorph tumorsejtek alkotják. Több magban ezen tumorféleségre jellegzetes maginclusiók azonosíthatóak. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képanyagából –Szirtes Ildikó gyűjtése)
|
A HCC különleges szöveti formája a fibrolammellaris carcinoma. Szövetileg a tumorsejtek nagyok, élénken eosinophilek, májsejtekre emlékeztetnek, gerendákba (trabeculák) rendeződnek. Ezek között köteges rétegezettségű, rostgazdag kötőszöveti stroma helyezkedik el. Leginkább fiatal korcsoportokban, gyakrabban nőkben fordul elő. A daganatmentes májállományban nincs cirrhosis. A tumorállomány sejtjei gyakran valamely endocrin markerre pozitívak. Az egyéb eredetű HCC-kel összevetve kórjóslata kedvezőbb.
A HCC további különleges formája az ún. „minute” (apró) carcinoma, amelynek mérete nevének megfelelően kicsi, definíciószerűen nem nagyobb 5 cm-nél (egyes szerzők szerint 3 vagy 3,5 cm-nél). A tumorocskának tokja van, cirrhoticus máj talaján alakul ki.
|
 |
A HCC májon belüli szétterjedésére – ha bekövetkezik – a portalis visszerekbe törés, illetve az epeutak mentén való terjedés jellemző. A centralis vénákba törés útján a daganat a májon kívülre, elsősorban a tüdőkbe juttat elsődleges metasztázist. A már cirrhoticus alapállapot miatt meglevő portalis pangás esetenként a köldökvisszér (v. umbilicalis) lumenének újbóli megnyílását, majd tágulatát eredményezi, ami a caput medusae-ként ismert portocavalis anasztomózisrendszer útján, a köldökvénában kialakuló retrográd áramlás segítségével hasfali, illetve köldök metasztázisok képződéséhez vezethet.
A nyirokrendszer útján regionális nyirokcsomó áttétek képződhetnek, ezek elsősorban a májkapuban keletkeznek, és ha kellő nagyságúra nőnek, másodlagosan nyomhatják a porta képleteit, így súlyosbíthatják az epeelfolyás, avagy a májkapuvisszér (v. portae) keringésének ilyenkor rendszerint amúgyis fennálló akadályozottságát. Közvetlen (per continuitatem) ráterjedéssel a tumor befoghatja a rekeszt is.
I./2.4.5.: Cholangiocellularis carcinoma (CCC)
|
 |
Az epeutak hámjából kiinduló, rosszindulatú daganat. Centralisan, azaz a májkapu közelében kialakuló példányai rendszerint nagyobbak és unilocularisak; topographiailag külön forma az ún. Klatskin-tumor, ami a ductus hepaticus communis villájában elhelyezkedő tumorra használt elnevezés. A perifériás helyzetű daganatok kisebbek és jobbára multilocularisak, ezek rendszerint cirrhoticus májban alakulnak ki. Kóroki tényezői között az alkoholizmus, a dohányzás, a májmételyfertőzés, a primaer sclerotizáló cholangitis (PSC) említendő.
Leginkább áttéti adenocarcinomáktól kell elkülöníteni, különösen a hasnyálmirigy és a gyomor rákjainak áttéteitől, ami sokszor alig lehetséges, tekintve, hogy finomszerkezeti (kórszövettani) és immunreaktivitási jellegzetességeik igen hasonlóak – mindenekelőtt a pancreas daganatok áttétei és az epeútrákok hasonlítanak egymásra kifejezetten. Utóbbira magyarázat, hogy mindkét struktúra közös fejlődéstani eredettel bír, és mindkettő az ún. „pancreato-biliaris egység” tagja. A máj primer cholangiocellularis carcinomáira a gyors progressio és a magas kiújulási arány jellemző, ezért kedvezőtlen kórjóslatú betegség.
|
 |
Macromorphologiailag szürkésfehér, tömött, elmosódó határú, tok nélküli daganat, amely néha a portalis terek hálózatát felhasználva kúszik szerte a máj állományában, így alkotva első pillantásra nehezen felismerhető tumoros hálózatot. Szövetileg szokványos megjelenésű adenocarcinoma tömör, rostgazdag neostromába ágyazva (scirrus). A változó kiérést mutató mirigy-, illetve járatképletek gyakran tartalmaznak mucint és/vagy epét.
Ritkán kombinált tumorok (HCC + CCC) fordulhatnak elő.
I./2.4.6.: Hepatoblastoma
Gyermekkorban előforduló, primitív, májsejtes daganat. Hirtelen növekszik, gyorsan progrediál, kedvezőtlen prognózisú. Makroszkóposan áltokkal határolt, velős tumorszövet jellemzi, a környező, tumormentes májállomány nem cirrhoticus. Szöveti szubtípusai:
-
- tisztán epithelialis,
-
- kevert epithelialis és mesenchymalis.
Serologiailag emelkedett AFP-értékek mérhetők. Egyéb szervek (szív, vese) fejlődési rendellenességei társulhatnak a tumorhoz.
I./2.4.7.: Haemangioma
|
 |
Jóindulatú, egyszeri vagy többszörös, rendszerint 5 cm-nél kisebb daganat, de nagyméretű tumorok is előfordulhatnak. Makroszkóposan mélyvörös színű, vérrel telt, részben thrombotizált, változó nagyságú érűrterekből áll, amelyeket vékony sövények választanak el. A korábban thrombotizált, majd szervült-hegesedett területeken a daganat színe fehéres, tapintata rugalmasan tömött. Szövetileg az érűrtereket lapos, típusos, nyugodt kórsejttani megjelenésű endothel béleli. Az ultrahang diagnosztika bevezetése előtt általában kórbonctani melléklelet volt, ma már azonban ultrahanggal még az élet során kimutatható. A subcapsularis elhelyezkedésű tumorok veszélye a spontán vagy traumához kötött megrepedés, következményes hasűri vérzés, az ún. akut has szindróma kialakulása, ezért e felszínhez közeli tumorok sebészi eltávolítása indokolt. Ritka, különleges formája a sclerotizáló haemangioma.
I./2.4.8.: Haemangiosarcoma/haemangioendothelioma
A máj ritka rosszindulatú tumorai, kóroktanilag vinil-chlorid-, illetve Thorotrast-expositio játszik szerepet. Többszörös tumorgócok jelentkeznek, a daganatot gyors progressio, kedvezőtlen prognosis jellemzi.
I./2.4.9.: Másodlagos (áttéti) májdaganatok
|
 |
A leggyakoribb májdaganatok. A máj a szervezet nagy része számára központi elhelyezkedésű szerv, így nem meglepő, hogy számos helyről kerülhet szövetébe tumoráttét. Mindemellett legelsősorban a splanchnicus terület rosszindulatú daganatainak áttéteivel kell számolni (5. mikrokép), elsősorban gyomorból, a hasnyálmirigyből, az epehólyagból és a májon kívüli epeutakból, a Vater-papillából, a vékonybelekből, a vastagbelekből a rectum felső harmadáig (a rectum alsó kétharmadának tumorai a cava-rendszeren át a tüdőbe metasztatizálnak!).
|

Tekintse meg a képet!
|

5. mikrokép: (HE; 400x) Metastasis hepatis. Az áttéti gócnak megfelelően a máj állományát mirigyszerű struktúrákból álló daganatszövet infiltrálja. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képanyagából –Szirtes Ildikó gyűjtése)
|
A splanchnicus területen kívüli rosszindulatú daganatok áttétei elsősorban az emlőből és a tüdőből származnak, illetve számítani kell melanoma malignum áttéteinek lehetőségére is bármely kiindulási helyről. Makroszkóposan gyakran többszörös, ritkán egyszeres, körülírt, kerekded, nem tokos, szürkésfehér tumorgócok (5. makrokép), amelyek közepükön elfolyósodhatnak, elhalnak, ez a colliquált szövet a ráktej. A közepén így elfolyósodott tumorgóc a felszínen egy középső helyzetű bemélyedést mutat, ez a rákköldök. A gyorsan (akár több kilóra) növő áttétek májmegnagyobbodást, térfoglalásuk útján májelégtelenséget okoznak. A többszörös áttétek képalkotókkal (pl. ultrahanggal) multiplex kerek árnyékokat mutatnak, ez az ún. lachée des ballons (léggömb-eregetésszerű kép).
|

Tekintse meg a képet!
|
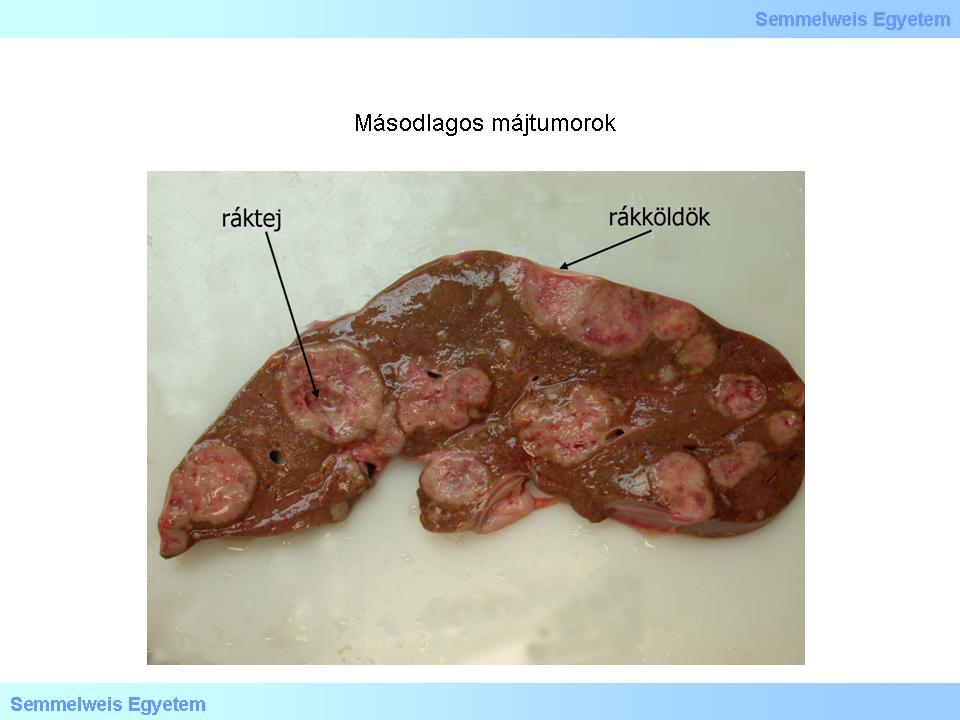
5. makrokép: Másodlagos májtumorok. Az áttéti gócok csaknem mindig multiplexek, jól körülírtak, általában szürkésfehérek. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Szirtes Ildikó gyűjtése)
|
I./2.4.10.: Tumorszerű laesiók
I./2.4.10.1.: Nodularis regenerativ hyperplasia (NRH)
|
 |
Fogalom-meghatározása szerint kötőszövetes tokkal rendelkező, nem neoplasticus (regenerativ) göbök megjelenése a májban. A folyamat lényege a máj bármely eredetű, helyi állomány-atrófiája és az ezt követő, kompenzatórikus regeneratio. Oka lehet portalis vénaág thrombosisa, az a. hepatica ágainak korosodással összefüggő arteriosclerosisa, vagy akár a primer biliaris crirrhosis kezdeti, még nem cirrhoticus elváltozásai.
Nodularis regenerativ hyperplasia jelenhet meg a máj elsődleges vagy áttéti tumorai mellett, vagy portalis hypertensióban, kísérőjelenségként is. Szövetileg olyan, heges tokkal határolt göböket látni, amelyek egynél több sejtsorból álló, regenerálódó májsejtlemezekből áll, míg a tokon kívüli állomány sejtjei összenyomottak és atrófiásak. A nodulus centrumában rendszerint portalis tér helyezkedik el. A cirrhosistól többek közt elkülöníti, hogy az egymásnak fekvő nodulusokat nem választja el kötőszövetes sövény.
I./2.4.10.2.: Partialis nodularis transzformáció (PNT)
Igen ritka, a nodularis regenerativ hyperplasiához hasonló, vagy azzal egylényegű elváltozás, csupán a képződő nodulusok nagyobbak. Itt is feltételezik a portalis thrombosis kóroktani szerepét, itt azonban a nagyobb, májkapuhoz közelebbi ágak rögösödéséről lenne szó.
I./2.4.10.3.: Focalis nodularis hyperplasia (FNH)
Nem teljesen tisztázott eredetű elváltozás, az általános megítélés szerint valamely helyi károsító hatásra adott, cirrhosisszerű hyperplasticus-regeneratoricus májszöveti válaszról van szó. Rendszerint soliter göb, az esetek ötödében mégis többgócúan jelenik meg. Oralis fogamzásgátlók kóroki szerepe kevésbé egyértelmű, mint a hepatocellularis adenomáknál. Felnőttekben erős női dominancia tapasztalható az előfordulás gyakoriságát tekintve, az arány 2:1-8:1 a nők javára. Férfiakban kialakulása elsősorban krónikus alkoholizmushoz köthető.
|
 |
Makroszkóposan legtöbbször subcapsularis, tömött térfoglalásként jelenik meg, amely metszlapon a nodulus szövetébe csillagszerű nyúlványokat bocsátó, középső helyzetű fibroticus területet tartalmaz. Szövetileg az eredeti májlebenyke minden komponense megtalálható. A csillagszerű kötőszövetes nyúlványok sövényszerűen állebenyekre tagolják a nodulus májszövetét, ami cirrhosisra emlékeztet. A sövények mentén epeútproliferatio alakul ki.
I./2.4.10.4.: von Meyenburg-komplexum (biliaris hamartoma)
Makroszkóposan egyszeres vagy többszörös, kicsiny, fehéres göböcskeként jelenik meg, főként subcapsularisan, vagy akár elszórtan a májállományban. Jóindulatú elváltozás, intraoperatíve mégis sokszor megtévesztésig utánozhat májáttétet, ami műtéti gyorsfagyasztásos szöveti ellenőrzést tehet szükségessé. Mikroszkóposan apró epeutak rendezetlen együtteséről van szó collagenrost-gazdag szöveti környezetben.
I./2.4.11.: A májrák (carcinoma hepatocellulare) molekuláris patológiai háttere
|
 |
A hepatocellularis carcinoma kialakulásának és progressiojának molekuláris hátteréről viszonylag korlátozottak az ismereteink. Mai ismereteink szerint a májrák általában aneuploid; igazolt kromoszómanyerésről főleg az 1q, 6p, 8q, 11q, 17q és a teljes 7-es kromoszómát érintően, igazolt kromoszómavesztésről a 4q, 6q, 8p, 13q, 17p és a 16-os kromoszóma mindkét karját illetően tudunk. A kromoszómális változások közül leginkább a 7q21-22 régió mutat összefüggést a metastatizálási képességgel, ehhez génjelölteket keresve in vitro a PFTK1 (PFTAIRE protein-kinase 1, CDC2-rokon gén) motilitásban való szerepét bizonyították.
Ezen felül négy jelátviteli út zavarát figyelték meg hepatocellularis carcinomában:
|
 |
-
1) a pRB-útét,
-
2) WNT-útét,
-
3) a STAT-útét és
-
4) a p53-útét.
-
- A pRB-úton, amely a sejtciklust befolyásolja, jellemző az RB vesztése vagy mutációja, a CDKN2A vesztése, hypermetilációja, mutációja, a cyclin-D1 génjének (CCND1) és a MYC-nek az amplifikációja.
-
- A WNT-úton hepatocellularis carcinomában a CTNNB1 mutációja elég gyakori (25-30%), míg az APC inaktiválása ritka (vastagbélrákban viszont ez a gyakori). További változás lehet az axin1 mutációja és az e-cadherin csökkent aktivitása. Itt is mutáció vagy a promoter hypermetilációja az ok, a következmény a sejtek közötti csökkent tapadáskészség (adherencia), valamint a β-catenin nagyobb koncentrációja a sejtmagban.
-
- A STAT-út aktiválását a SOCS1 gén promoterének hypermetilációja okozza, aminek következtében a JAK2 gátlása elmarad és aktiválódnak olyan célgének, mint az IL6. (Az IL6 mint „cytokin” ismeretes, amely főleg az immunrendszer elemeivel áll kapcsolatban, de szabályozhat hámsejteket is, különösen a hepatocytákat.) A TP53 funkciója a legtöbb hepatocellularis carcinomában elégtelen. Az európai, amerikai és japán hepatocellularis carcinomáknál a mutáció a DNS-kötő domén egészében megtalálható, az afrikai és ázsiai eredetnél a „forró pont” a 249 kodonban van (AGG helyett AGT, azaz arginin helyett szerin). Ez az a mutáció, amelyet aflatoxin-B1-gyel kísérletesen is indukálni lehet, és főleg krónikus HBV-fertőzésnél alakul ki. Megfigyelték, hogy a TP53 mutációi és a WNT-út hibái gyakran fordulnak elő együtt.
A növekedési faktorok és receptorok közül azok fontosak hepatocellularis carcinomában, amelyek a normális máj esetében is. TGF-alpha/EGFR: a TGF-alphát termelhetik a daganatsejtek, és ha az EGFR-t is expresszálják, akkor autocrin stimulatioról van szó. HGF/MET: a TGF-alphával ellentétben a HGF-t (májsejt növekedési faktor) nem a hámelemek termelik, hanem májzsugor vagy májrák kialakulása során a mesenchymális sejtek aktiválódnak (különösen a Disse-térben, a hepatocyták és az endothelsejtek között elhelyezkedő Ito-sejtek), myoepithelialis sejtekké alakulnak, és nemcsak maguk, hanem a környezetük (a daganatsejtek és más stromasejtek) számára is növekedési faktorokat termelnek, mint pl. a HGF-et. A HGF hatását növeli, ha a MET fokozottan expresszálódik. Mind a MET, mind az EGFR a 7-es kromoszómán helyezkedik el, amely hepatocellularis carcinomában „nyerést” mutat.
|
 |
IGF2 és receptora: az IGF2 túltermelődik hepatocellularis carcinomában (Wilms-tumorban ez a központi esemény), amelynek hátterében a Wilms tumorhoz hasonlóan lehet LOI (loss of imprinting), de más tényezők is befolyásolják az IGF2 funkcióját. Az IGF2 az IGFR-I-en vagy az inzulin receptor hasítási változatán, a hIRl-en keresztül hat, aktiválva a MAPK-t és, ami talán még fontosabb, a PI3K-utat. Az inzulinnak lényegében hasonló a hatása, mint az IGF2-nek, de az inzulin főleg az anyagcserére hat, az IGF2 pedig növekedési faktor. Utóbbit normálisan az IGFR-II csökkenti, mert míg valóban „receptorként” viselkedik és megköti IGF2-t, ennek nem stimulatio a következménye, hanem lebontás (ezért „scavenger receptor” az IGFR-II).
Kötődéssel lesz gátló tényező a p53 által indukált IGFB3 is. Azt lehet mondani, hogy az IGF2 működése az IGFR-I és -II expressiós szintjeitől függ. Az IGFR-II gén a 6q27 lókuszon található, amelynél hepatocellularis carcinomában gyakran fordul elő LOH (loss of heterozygosity). Bár az IGF2 hatásai hepatocellularis carcinomában még nem tisztázódtak, a szerepe aligha kétséges, amit aláhúznak az IGFR-I aktiváló pontmutációi is.
|
 |
A májban zajló krónikus gyulladás (aminek számos oka lehet: öröklődő betegség, alkohol, vírusfertőzés stb.) ideális környezet a génhibák felhalmozódására, mert állandósul a sejtpusztulás, a sejtújdonképződés (regeneratio), aktiválódnak a stroma és az extracelluláris mátrix elemei. Ugyanakkor a regeneratív májsejt-proliferatio sokszor csak frusztrán folyamat, mert a szerkezet nem tud helyreállni. Mindeme folyamatok alatt, a fokozott sejtváltás (turn-over) miatt fennáll a veszélye, hogy a károsításnak legellenállóbb sejtek a proliferatiós versenyben végül alulmaradjanak, kiválogatódjanak, ezzel fokozva a daganat kialakulásának esélyét.
A hajlamosító okok között vezető szerepet játszanak a vírusok okozta hepatitisek: a fenti mechanismusok hatására pl. krónikus HBV-fertőzés esetén a hepatocellularis carcinoma kialakulásának kockázata kétszázszorosára emelkedik. HBV-fertőzésben insertiós mutagenesis zajlik, a cisz-aktiváció célgénje lehet a telomeráz, a kalcium-homeostasist befolyásoló vagy a MAPK-jelutat meghatározó fehérjék génjei. A HBV-fertőzöttekben kialakuló hepatocellularis carcinomák integrált HBV DNS-t hordoznak, ami felhasználva a virális enhancer-régiót, protoonkogéneket (pl. cyclin géneket) aktiválhat, vagy suppressor géneket inaktiválhat.
Az idegen vírusgenom saját beépülési helyét általában instabillá teszi, új „fragilis helyet” hozva létre. A transzaktiváció eredményeképp az integrált vírus-DNS HBx-et és preS2/S-t termel, ezek közül különösen HBx-et produkál jelentős mennyiségben, ami nem kötődik a gazdasejtek DNS-éhez, de számos gént (pl. cyclin-A, p53, CREB, ATF2, DDB1, EGFR, TGFβ1, AP2, IL8, VEGF) aktiválhat vagy inaktiválhat, illetve transcriptiós faktorokat aktivál, fokozza antiapoptoticus gének expresszióját (sejt-immortalisatio), serkenti a proliferatiót, elősegíti a p53 lebontását. A keletkezett mutánsok ugyancsak számos szabályozó rendszer működését változtatják meg (pl. PKC-út, NFkB, AP1, TGF-alpha, IGF2).
A HCV nem integrálódik a gazdasejt genomjába, de számos szabályzót befolyásol, leggyakrabban a „core” és az NS5A-, NS4A- és NS4B-géneken, pontosabban ezek fehérjéin keresztül. Fontos szerepet játszanak a fertőzés hatására keletkezett reaktív oxigéngyökök, erősítve túlélést támogató tényezők (TNF-alpha, Bcl2, NFkappaB, RAF, β-catenin) aktivitását, és gátolva pl. a p53-at. Aktiválódnak különböző transcriptiós fakorok is (pl. SP1, EGR1).
Az alkohol esetében a metabolit, az acetaldehyd károsít, elősegítve reaktív oxigéngyökök keletkezését, gátolva az antioxidánsokat, csökken a DNS-hibajavítók aktivitása is. Az alkohol különösen a HCV-vel együtt fokozza a hepatocellularis carcinoma kialakulásának veszélyét.
Az aflatoxin-B1 főleg a meleg és nyirkos éghajlaton fordul elő és viselkedik carcinogenként. A DNS-adduktok képzésében a metabolitjai vesznek részt (AFB1-exo-8,9-epoxid, AFB1-FAPY). Jellemző a p53 mutációja (249-es kodonban), ennek következtében inaktiválódása, a DNS-hibajavítás hatásfokának csökkenése. Szerepet tulajdonítanak még a WNT- és a Hedgehog-jelút hibáinak és más génhibáknak (pl. IGF-2, RASSF1A, p16).
Az obesitas és a diabetes mellitus más anyagcserezavarokkal és arteriás hypertensióval együtt a nem alkoholos steatohepatitis és a cryptogen cirrhosis leggyakoribb oka. A malignus transzformációban a reaktív oxigéngyökök károsítása mellett pl. az IGF-1 és -2, az inzulinreceptor és valószínűleg a PARP is szerepet játszik.
|
 |
Az etiológiához nem kötődő génhibák közül hepatocellularis carcinomában ritka a KRAS mutációja, illetve a RAF fokozott termelése. A RAS inaktiválása elmaradhat a GTPáz aktiváló fehérjék (azaz a RAS-t kikapcsoló fehérjék, pl. RASSF1A, RASAL1, DAP21P, NF1) csökkent működése, leggyakrabban a promoterek metilációja miatt. A PI3K úton az AKT termelése nő és a PTEN csökken. A sejtciklust szabályozók közül a cyclin-D1 amplifikált, a cyclinfüggő kinázok gátlói (p16, p21, p27) pedig gátoltak, a növekedési faktorok közül gyakran expresszálódik a TGFβ (82%), a vele kapcsolatban levő mannóz-6-foszfát/IGFR-2, valamint a proangiogén bFGF, VEGF (60%) és PDGF. Más gének funkciója is csökken a promoter metilációja miatt: pl. E-cadherin, CASP8, TIMOP, MLH1, MSH2, MGMT, SEMA3b, míg fokozódik a DNS-metiltranszferáz és a p-cateniné aktivitása, utóbbi felhalmozódik a sejtmagban.
A mikroRNS-ek közül a felnőtt májban főleg a miR-122 expresszálódik (szerepe jelenleg vizsgálat tárgya a hepatocellularis carcinogenesisben). Célpontjai, azaz cél-mRNS-ei között szerepel a CAT1, az NMYC és a cyclin-G1. Gyakran csökken a miR-145 és a miR-199b expressziója, míg a miR-224-é növekszik a praemalignus dysplasticus nodulusokban, és megmaradnak a HBV-hez társuló hepatocarcinogenesis során is. A hepatocellularis carcinoma progressiojával kapcsolatot mutat a 17q21-22 nyerése.
Ebben a régióban hét gén szerepét feltételezik:
|
 |
-
1) a PFTAIRE protein-kináz-1 (PFTKI) fokozott expressziója és a „malignus hepatocyták” motilitási képessége között mutatkozik összefüggés, ami az áttétképző-képességhez járulhat hozzá;
-
2) ODAG;
-
3) CDK6;
-
4) CAS1;
-
5) PEX1;
-
6) SLC25A;
-
7) PEG10.
|

Tekintse meg és elemezze a táblázat tartalmát!
|
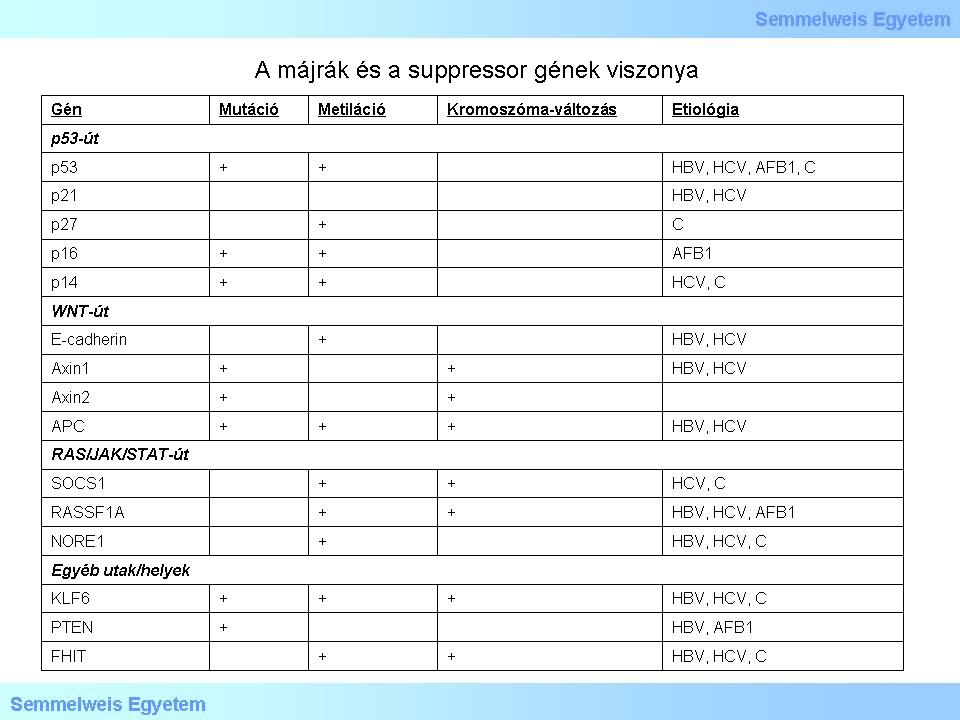
3. táblázat: A táblázat a májrák és a suppressor gének viszonyát szemlélteti
|
I./2.4.12.: Az epehólyag- és epeútrákok (carcinoma cholangiocellulare) molekuláris patológiai háttere
|
 |
Epehólyagrákokra vonatkozóan igen kevés a rendelkezésre álló adat. Korai eseménynek tartják az invazív állapotban gyakori p53-mutációt és a LOH-t néhány kromoszóma-szakaszon (pl. 8p – 44%, 9p – 50%, 18q – 31%), bár az érintett – feltehetően suppressor – géneket még nem ismerjük. Késői eseménynek tartják a KRAS-mutációt (0-34%), illetve leírtak HER2 és COX2 amplifikációt is.
Az intrahepaticus epeútrákokban a KRAS (4-100%, a földrajzi eltérések nagyok) és a p53 mutációja (kb. 30%) a leggyakoribb. Fokozott expressziót találtak a HER2, a MET, a Bcl2, míg csökkenő expressziót az e-cadherin és a cateninek esetében. Leírtak HER2 és COX2 amplifikációt is.
Az extrahepaticus epeútrákokban és a Vater-papilla daganataiban is gyakori a KRAS-mutáció (50-60%) és a késői p53-mutáció, de az utóbbiban az APC csírasejtes vagy szerzett mutációja egyaránt előfordul.
I./2.4.13.: Gén-lecsendesítés (promoter metiláció) hepato- és cholangiocellularis carcinomában
|

Tekintse meg és elemezze a táblázat tartalmát!
|
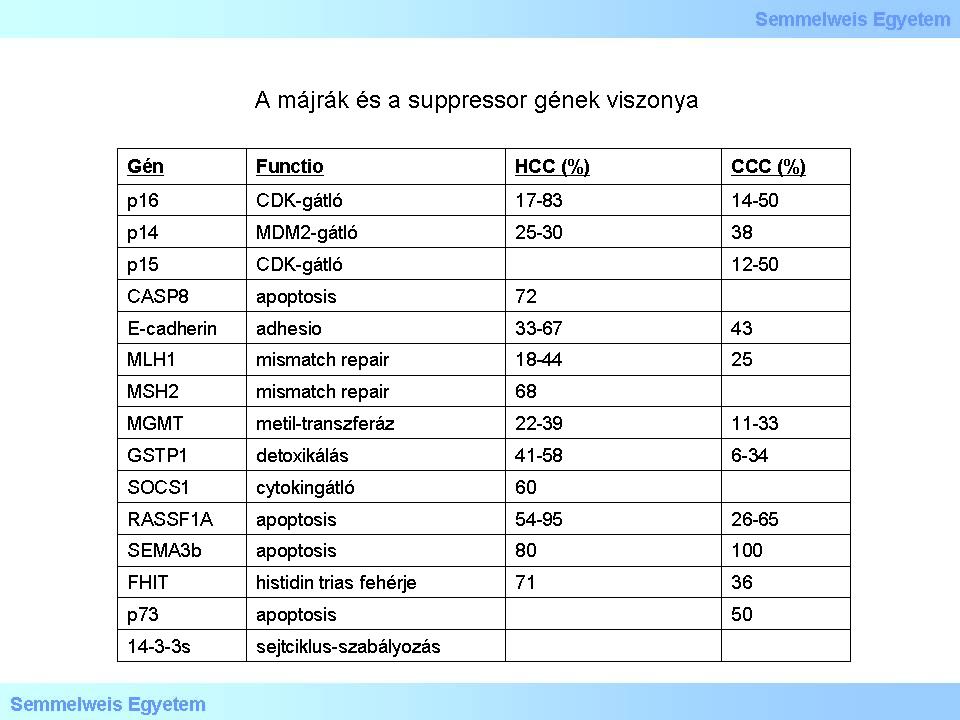
4. táblázat
|
I./2.4.14.: Célzott terápia
|
 |
A hepatocellularis carcinoma hagyományos kemoterápiás kezelése meglehetősen szerény eredményekkel jár. Ezért is előzte/előzi meg nagy várakozás a molekuláris célpontok elleni terápiát. A májrák jellegzetességei közé tartozik a RAF és néhány más tirozin-kináz mutációja, így érthető, hogy a sorafenib (multikinázgátló, többek között a RAF gátlója) alkalmazásával előrehaladt májrákokban a korábbiakhoz képest a túlélési arány jelentős javulását érték el. A lokális kezelésben nem részesíthető, inoperábilis hepatocellularis carcinoma elsővonalbeli kezelésében a sorafenib adása előnyös. Bíztató klinikai vizsgálatok folynak az ugyancsak multikinázgátló sunitinibbel is. Ígéretesek még az olyan kombinációk is, mint amilyen az erlotinib + bevacizumab, illetve a sorafenib + doxorubicin.
A RAS vagy RAF fokozott aktivitása esetében logikus kezelési irány lehet a MEK gátlása szelektált betegeknél (pl. selumetinib, fázis II). Célpontot jelenthetnek a PI3K-jelút állomásai is, így az mTOR vagy más jelutak, mint az IGFR-gátlók, illetve a mellékhatások miatt eddig kudarcot vallott WNT-út esetleges gátlása.
|
|