 |
I./2.5.: Ischämische Herzerkrankungen
I./2.5.1.: Koronararteriensklerose (coronariasclerosis) als kardialer Vertreter der Gefässverkalkung
I./2.5.1.1.: Einführung
Der anatomische Aufbau der Herzkranzgefässe sieht folgendermassen aus: aus den subepikardialen Hauptästen der Koronarien entspringen die epikardialen Nebenäste, aus denen dann die intramuralen Begleitarterien abzweigen, die eigentlich Endarterien darstellen, aus denen aber noch einige wenige subendokardiale Äste entspringen. Dieser Gefässaufbau spielt beim ischämischen Geschehen des Myokardiumes (Infarkt) eine wichtige Rolle. Es werden 3 Hauptäste der Kranzgefäße unterschieden, die für die Blutversorgung des gesamten Herzens zuständig sind: die rechte Koronararterie (a.coronaria dextra), der vordere septale Ast der linken Kranzarterie (r. interventricularis anterior) und der das Herz kreisförmig umgebende Ast der linken Koronararterie (r. circumflexus).
Es gibt natürlich mehrere Variationen im Verlauf der Herzkranzgefässe, so z.B. die subepikardialen Äste des Kranzgefässes, die an einigen Stellen unter die Oberfläche der äusseren Muskelschicht eingebettet sind, dort unter einer sog. Muskelbrücke hinweg einige Zentimeter lang verlaufen, und schließlich wieder ins subepikardiale Fettgewebe einmünden. Es ist interessant, dass ein noch so verkalktes Kranzgefäss bei seinem "Ausflug" ins intramurale Gewebe von der Sklerotisierung verschont bleibt, was nur mit der stützenden Funktion der Muskelschicht erklärt werden kann. Das bedeutet, dass die intramural verlaufenden Gefässabschnitte vor dem vom pulsierenden Blutstrom gebildeten Mikrotraumen der Intima geschützt sind, und damit weniger atherogenes Material in die Arterienwand gelangen kann.
Leider bringt aber auch diese besondere Schutzfunktion der Gefäße kein positives Ergebnis, da beim Ein- bzw. Austreten der Gefässe unter die Muskelbrücke eine noch stärkere Sklerosierung der Gefässe auftritt, als anderswo; d.h., dass an der Stelle, wo ein von aussen gestütztes Gefäss zu einem ungestützten Gefäss wird, eine stärkere Verkalkung zu sehen ist, da die Gefässwand genau dort wegen den hämodynamischen Verhältnissen einer noch höheren Krafteinwirkung ausgesetzt ist; all dies hat eine noch stärkere Insudation der atherogenen Stoffe in die Gefäßwand zur Folge.
I./2.5.1.2.: Verengung der Herzkranzgefässe, bzw. Gründe für einen Gefässverschluss
|
| |
Bei 80-90 % der Fälle ist die Arteriosklerose der Grund für eine Verengung der Koronararterien, deren grösste Gefahrenquelle für Komplikationen die Plaques dargestellen (Einblutung, Thrombose). Eine Embolie der Herzkranzgefäße ist äusserst selten, ebenso die angeborenen Entwicklungsstörungen der Kranzgefässe, wie z.B. die Hypoplasie der Koronarien bzw. Variationen im Ablauf der Herzkranzgefässe, z.B. wenn eine normal aus dem Aortenbogen entspringende Koronararterie über die Aorta hinweg zur gegenüberliegenden Herzhälfte verläuft. Weitere Gründe für die Verengung der Kranzgefässe sind Entzündungen, Autoimmunerkrankungen, ein Gefäßwandspasmus (Prinzmetall –„Variante” der Angina) oder die Bildung von Muskelbrücken sein.
I./2.5.1.3.: Einteilung der Koronararterienverhärtungen
|
 |
1. Man kann die Koronarsklerose nach der Menge der befallenen Oberfläche innerhalb des Gefäßes in eine sog. zentrale, periphere und diffuse Kranzgefäßerkrankung einteilen. Bei der zentralen Form befinden sich die sklerotischen Veränderungen am ersten Abschnitt der Kranzgefässe, direkt nach Ihrer Abzweigung aus der Aorta; diese Gefässe haben einen Durchmesser von mindestens 0,1 cm. Die Bezeichnung als "zentral" bedeutet in diesem Fall also nicht ein zentral gelegenes Gefäss, sondern zeigt die technisch-funktionelle Grenze eines Gefässes, vor allem in Anbetracht darauf, dass bei einem Bypass ein Gefäss mit diesem Durchmesser überbrückt werden kann. Die periphere koronare Gefäßerkrankung, anders gesagt, die Erkrankung der kleinen Gefässe, betrifft die Gefässe mit einem Kaliber <0,1 cm; diese Gefässe können nicht durch einen Bypass ersetzt werden. Diese Erkrankung ist relativ selten. Die diffuse Kranzgefässerkrankung betrifft sowohl die zentral, als auch die peripher gelegenen Gefässe, und vertritt die häufigste Form der Arteriosklerose. Am Erfolg einer Überbrückung dieser Art der Sklerose mit einem Bypass (CABG - coronary artery bypass grafting) wird auch gezweifelt.
2.Die Anzahl der betroffenen Gefäße kann auch als Grundlage einer weiteren Einteilung dienen: man kann eine sog. Einzelgefäss- (single vessel disease), eine Zweigefäss- (two vessel disease) und eine Dreigefässerkrankung unterscheiden (three vessel disease). Die Einzelgefässerkrankung besteht seit weniger als 3 Jahren, und es bestehen pektanginöse Beschwerden im Brustkorb; bei der Dreigefässerkrankung bestehen die pektanginösen Beschwerden in der Regel länger als 3 Jahre, und die Schmerzen strahlen auch in den Arm, die Wirbelsäule und den Rücken aus.
3. Der Schweregrad der Erkrankung der betroffenen Gefässe kann auch eine Unterscheidungsgrundlage bieten, und man kann die Gefässwandverhärtung so in eine leichte, mittelschwere und schwere Form einteilen. Bei einer leichten Koronararterienverhärtung beträgt die Einengungen des Gefässdurchmessers weniger als 50 %, bei einer mittelmässigen Sklerose beträgt die Verengung 50-75 %, bei einer schweren Herzkranzerkrankung liegt die Einengung des Durchmessers bei über 75 %. Bei einer mittelschweren Gefässerkrankung zeigt das Ruhe-EKG noch keine Veränderungen, bei einer schweren Verengung zeigt das Belastungs-EKG schon eindeutige Zeichen einer Kranzgefässinsuffizienz.
I./2.5.1.4.: Die therapeutische Wiederherstellung des koronaren Blutflusses
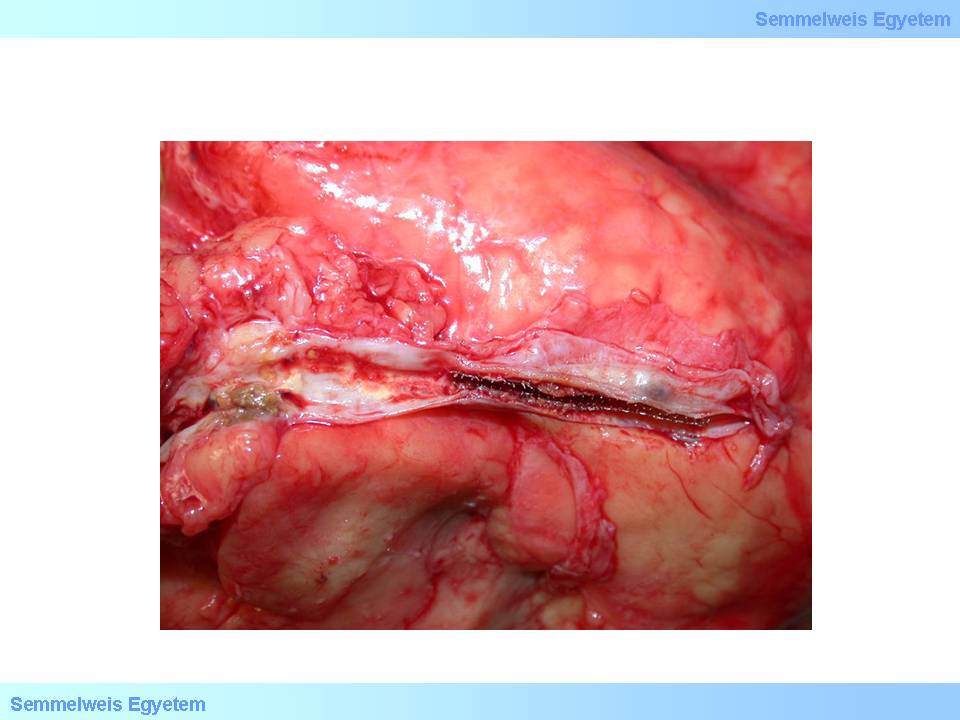
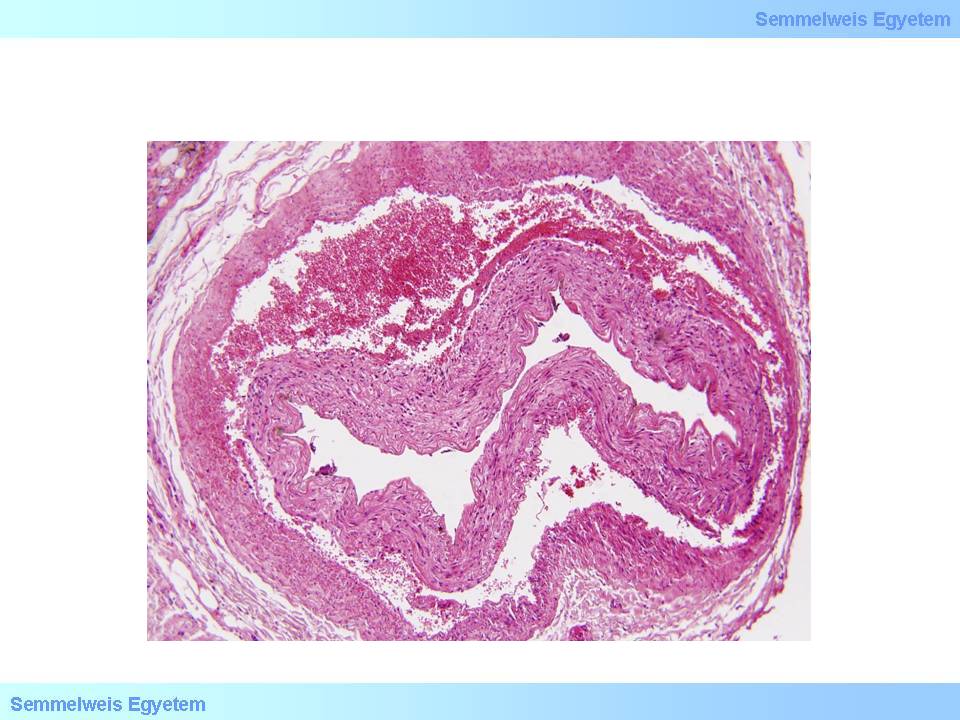
Die Wiederherstellung des koronaren Blutflusses kann klinisch mit Medikamenten (antithrombotische Mitteln, gefässerweiternde Mittel, usw.), oder durch einen operativen Eingriff versucht werden. Die offene Herzoperation gilt dabei heutzutage schon als klassische Methode, bei der bestimmte Arterienabschnitte überbrückt werden (CABG - coronary artery bypass grafting), und die Herzmuskulatur so wieder zu einer ausreichenden Menge an Blut gelangen kann (3. Makrofoto). Hierfür wird am häufigsten die an einer langen Strecke gut zugängliche, ohne nennenswerte negative Folgen gut entfernbare V.saphena magna benutzt (1-3 Mikrofoto); als weiteres Überbrückungsgefäss kann auch die A.mammaria interna benutzt werden, die an der Innenfläche des Brustkorbes von der A. subclavia abzweigt, und in Richtung des Zwerchfelles verläuft; in einigen Fällen wird ein Teil der A. radialis als Bypass benutzt.
|

Beurteilen Sie die Fotos!
|
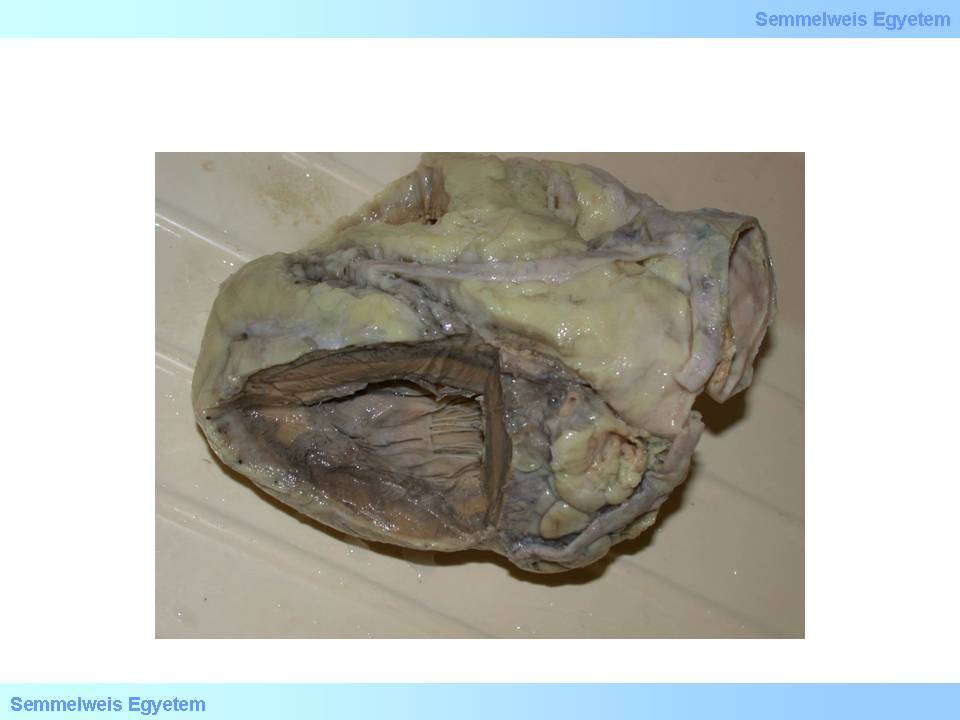
3.Makrofoto: Zweifacher Bypass am absteigenden Ast der linken Koronararterie und der A.circumflexa. Die distale Anastomose des Bypasses, der die linke Koronararterie überbrückt, zeigt einen Totalverschluss (Anastomosen-Thrombose) (Museum des II. Pathologischen Institutes der Semmelweis Universität, Budapest).
|
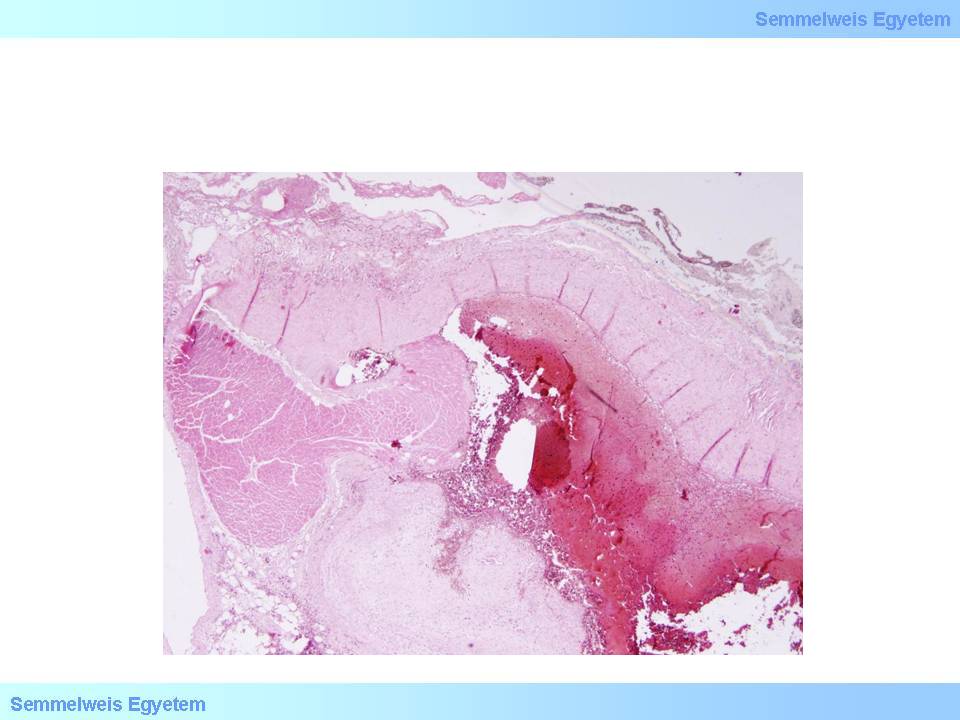
1. Mikrofoto: (HE;40x) Verengungen der Anastomosen von Bypässen (I.)- Anastomosen-Thrombose. Man kann nur wenige Zehntelmillimeter von der Anastomose des Bypasses entfernt ein winziges Stück des Myokardiums sehen, dass durch die Naht ins Lumen des Bypasses gezogen worden ist, und hier einen thrombotischen Verschluss verursacht hat (II. Pathologisches Institut der Semmelweis Universität, Budapest).
|
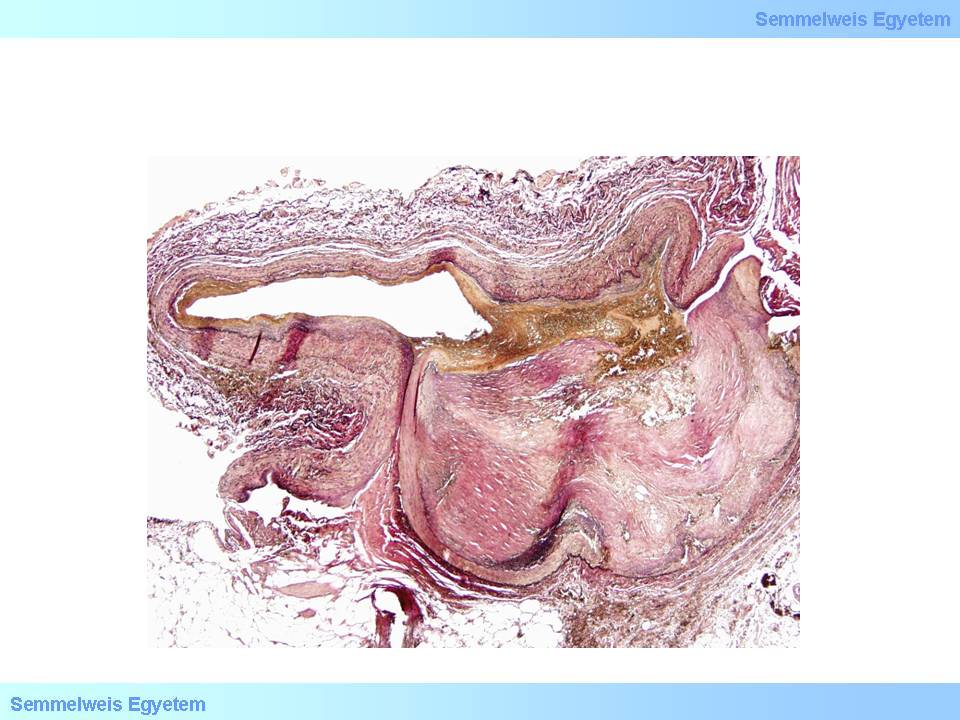
2. Mikrofoto: (Hart van Gieson;40x) Verengungen der Anastomosen von Bypässen (II.)- gespaltenes Plaque. Die Plaque-Ablagerung hat sich wegen dem Eingriff am Gefäss leicht gespalten, woraufhin sich dort ein Thrombus gebildet hat (II. Pathologisches Institut der Semmelweis Universität, Budapest).
|
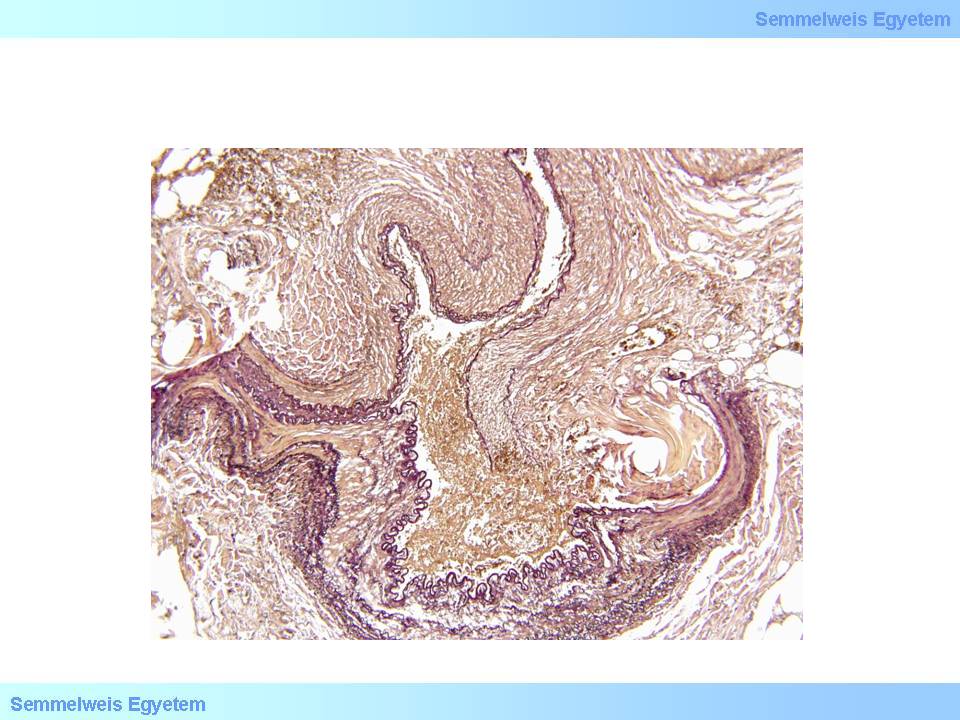
3. Mikrofoto: (Hart van Gieson;40x) Verengungen der Anastomosen von Bypässen (III.)- Riss der Anastomose. Der Bypass ist an einer Stelle von der zu überbrückenden Koronararterie abgerissen, und es hat sich so eine Nahtinsuffizienz gebildet, die die Öffnung des Bypasses verengt (II. Pathologisches Institut der Semmelweis Universität, Budapest).
|
|
 |
Die mit minimalinvasiven Methoden arbeitende sog. Intensiv-Kardiologie wird immer populärer, bei der man durch eine größere periphere Arterie (z.B. A.femoralis) einen Katheter einführt, über den man einen vorher festgelegten Gegenstand zur Behandlung eines Gefässverschlusses in das Herz einführen kann: bei einer Angioplastik einen aufblasbaren Ballon, der die Plaqueauflagerung, die eine Verengung verursacht, platt drücken kann; bei einer Endarterektomie wird ein scharfer Gegenstand eingeführt, mit dem man Wandplaques entfernen kann; ein Stent wird auch durch solch eine periphere Arterie eingeführt (beim Loslassen des Stentes öffnet sich dieser und bildet eine Röhre aus Maschendraht - 4. Makrofoto.). Sammelbegriff für diese minimal invasiven Techniken ist der der perkutanen koronaren Intervention – percutan coronaria intervention (PCI).
|

Beurteilen Sie das Bild!
|
4. Makrofoto: A.coronaria nach einer Stent - Implantation (Bildarchiv des II.Pathologischen Institutes der Semmelweis Universität, Budapest).
|
I./2.5.2.: Ischämische Herzerkrankung
I./2.5.2.1.: Begriffsdefinitionen und Einführung
|
 |
Unter dem Begriff der ischämischen Herzerkrankung fasst man sämtliche klinisch- pathologischen Ereignisse zusammen, die zu einer ungenügenden Sauerstoffversorgung der Herzmuskulatur, und damit zu den entsprechenden Herzmuskelschädigungen führen können. Früher nannte man diesen Begriff: koronare Herzerkrankungen (coronary heart disease).
I./2.5.2.2.: Auslöser einer ischämischen Herzerkrankung
Die Gründe für eine ungenügende Sauerstoffversorgung der Herzmuskulatur, also für eine ischämische Herzerkrankung können
-
1) koronarer Herkunft (coronarial) und
-
2) nicht koronarer Herkunft (extracoronarial) sein.
|
| |
1. Bei den ischämischen Herzerkrankungen koronarer Ätiopathogenese sind vor allem die subepikardialen Hauptäste und/oder die intramyokardialen kleineren Arterien betroffen. Die subepikardialen Hauptäste der Koronararterie sind meist von einer stenotisierenden Koronarosklerose (über 90 %!) und von dessen Komplikationen betroffen (sog. Plaque- Komplikation: thrombotisierte Usuriationen bzw. eingeblutete Rupturen); die Spaltung der Gefässwand (Dissektion) kommt weniger häufig vor (4. Mikrofoto); eine Embolie der Koronararterien, und das sog. Steal-Syndrom (z.B. bei einer myokardialen arteriovenösen Malformation, beim Coronary-subclavian-steal-Syndrom, wo eine Koronararterie mit der A.mammaria int.überbrückt wird) sind sehr selten. An den intramyokardialen kleinen Gefässen (small vessel disease) können sich ein Spasmus, eine perivaskuläre Fibrose, die Ablagerung von Amyloidproteinen (sog. obstruktiv intramurale Koronar-Amyloidose) oder eine sog. Thrombozytenaggregation bilden. All dies führt zu einen relativen Sauerstoffmangel der Herzmuskulatur.
|

Beurteilen Sie das Bild!
|
4. Mikrofoto: (HE;40x) Dissektion der Koronararterie. Bei der Spaltung einer Gefäßwand ist folgender pathologischer Mechanismus zu sehen: die von den äusseren Schichten der Gefässwand abgetrennte inneren Gefäßwand wird hier wie ein Stück Stoff in das Lumen des Gefäßes distal der Spaltungsstelle hineingestopft, und das von proximal einfliessende Blut wird dort aufgestockt. Bei der Spaltung eines Gefässes ist es typisch, dass sich dieser Vorgang auch auf plaquefreie Stellen distal der Rissstelle ausbreiten kann, da das in den Spalt einlaufende Blut zwischen den Wänden auf keinen Widerstand trifft, und die Gefässwandschichten weiter spaltet; dieser Vorgang ist besonders dann wichtig, wenn die in das Lumen gestülpten inneren Gefässwandschichten das Gefäßlumen total verstopfen, und es zu einer kompletten Tamponade kommt. So kann sich eine Dissektion der Aorta auch bis auf die Herzkranzgefässe ausbreiten. Kommt es nicht zu einer solchen Tamponade, kann die Spaltung des Gefässes schon bei einem minimalen Widerstand (z.B. ein vernarbender Plaque) gestoppt werden, bzw. das Blut kann über einen weiteren Riss in der Gefässwand wieder Richtung Lumen abfliessen, oder nach aussen in die perivaskulären Gewebe eindringen ( II. Pathologisches Institut der Semmelweis Universität, Budapest).
|
2. Zu den extrakoronaren Gründen für eine ischämische Herzerkrankung gehören die Hypertrophie des Herzens (das Herz wiegt über 500 g: die zu versorgende Muskelmasse ist zu gross, als dass sie von den Herzkranzgefässen ausreichend mit Sauerstoff versorgt werden könnte); eine Aortenstenose, bzw. Stenosen der Aortenklappe (das Blut gelangt nur bei einem erniedrigten Volumen, und durch vermehrte Muskelarbeit bis in die Kranzarterien) führt auch dazu; eine Anämie (die Anzahl der zum Sauerstofftransport fähigen Zellen ist erniedrigt), ein Schock (plötzlicher Verlust des Sauerstoff transportierenden Blutes), erniedrigte Sauerstoffsättigung in der Luft (der zur Verfügung stehende Sauerstoff in der Luft sinkt, z.B. auf höheren Berggipfeln), eine Lungenentzündung (die zur Sauerstoffaufnahme fähige Lungenoberfläche ist erniedrigt), oder jegliche Art von erhöhtem Sauerstoffbedarf (z.B. erhöhte physikalische Belastung, die bei den mehr oder weniger verengten Herzkranzgefässen plötzlich eine relative Insuffizienz verursachen) verursachen auch eine ischämische Herzerkrankung.
I./2.5.2.3.: Kliniko - pathologische Zeichen der ischämischen Herzerkrankung
Zu den akuten Erscheinungsformen einer ischämischen Herzerkrankung gehören
|
 |
-
a) die Angina pectoris, der
-
b) plötzliche Herztod, und
-
c) der Herzinfarkt (infarctus myocardii).
Die chronische Variante dieser Erkrankung zeigt sich kliniko-pathologisch in der (iv) chronisch ischämischen Herzerkrankung (cardiopathia ischaemica chronica) .
|

Beurteilen Sie der Verweis!
|
I./2.5.2.3.1.: Die Angina pectoris
Erstbeschreiber dieses Phänomens war W.Heberden 1768 (s.Text der uns überlassenen Vorlesung Bei der stabilen Form der Angina sind die Schmerzen relativ gut vorhersehbar, sie kommen nämlich proportional zu einer physikalischen Belastung vor. Im Hintergrund dieses Phänomens steht eine starke Arteriosklerose, bei der das zu versorgende Gebiet aber noch durch die Bildung interkoronarer Anastomosen – also einem Kollateralkreislauf - soweit mit Sauerstoff beliefert werden kann, dass sich kein Infarkt bildet; der ischämische Muskelschmerz aber, der auf die langsame, immer weiter fortschreitende Verengung des Koronararterienastes zurückzuführen ist, ist aber nicht mehr zu umgehen Bei einer instabilen Angina kommen die Schmerzattacken unerwartet - auch im Ruhezustand -vor , was bedeutet, dass dies ein prä –infarktiöser Zustand ist. Die Prinzmetal -Angina (Prinzmetal;1959) kann sogar bei ansonsten gesunden Herzkranzgefässen einen Gefässspasmus ausgelösen, was heftige Schmerzattacken mit sich bringt, die meist im Ruhezustand auftreten und spontan wieder vergehen.
|

Beurteilen Sie der Verweis!
|
I./2.5.2.3.2.: Der plötzliche Herztod
Die Inzidenz dieser Erkrankung beträgt in der westlichen Welt 30 Todesfälle/Woche/pro 1 Millionen Einwohner. Der plötzliche Herztod ist sehr oft (75 %) auf eine schwere Koronarosklerose zurückzuführen; weitere Gründe für einen plötzlichen Herztod können extrakoronariale Herzerkrankung (ca. 20 %) wie z.B. eine elektromechanische Instabilität des Herzens (sick- sinus- disease, eine AV- Knoten- Erkrankung, WPW- Syndrom, ein Kammerflimmern, Bradykardien), bzw. strukturelle Änderungen des Herzens (Vitien, Kardiomyopathien, infektiöse Endokarditiden, eine Myokarditis, Funktionsstörung ersetzter Klappen, oder eine Herzruptur) sein. Bei 5 % des plötzlich vorkommenden Herztodes ist keine Todesursache nachweisbar; hierzu gehören die idiopathische Kammerfibrillation, anders gesagt "mors sine materia", die auf eine familiäre molekulargenetisch vererbte Fehlbildung des Herzens beruht, und bei der die elektronische Fortleitung der Herzimpulse fehlerhaft ist. Histologisch sieht man bei 67 % der Fälle eine Koagulations-Myozytolyse, die durch die Hyperaktivität des sympatho-adrenergen Nervensystems, Stress und physikalische Belastung zustande kommt.
|
| |
Das Adams- Stokes Syndrom kann auch zum plötzlichen Herztod führen; dieses Syndrom ist mit verschieden lang dauernden (einige Sekunden bis zu mehreren Minuten), plötzlichen Herzstillständen gekennzeichnet; dadurch kommt es zu einer Minderdurchblutung des Gehirns, und zu verschieden schweren Bewusstseinsverlusten. Klinisch sieht man einen plötzlichen Schwächeanfall, Schwindel und u.U. einen totalen Bewusstseinsverlust. In diesem Fall ist der Puls nicht tastbar, es gibt keine Systole und keine hörbaren Herztöne; der Blutdruck fällt plötzlich, und der Patient bildet tonisch-klonische Krampfanfälle; die Überlebenschance bei so einem Anfall hängt von der Länge des Herzstillstandes ab, die im Extremfall auch zum Tode führen kann. Einteilung des Adams-Stokes Syndromes nach der Dauer: einige Sekunden "forme fruste" , die Schwindelanfälle verursachen; bei einer Dauer von über 10 Sekunden wird auch das Gesicht blass, und es kann zum Bewusstseinsverlust, klonischen Muskelzuckungen und einer Pupillenerweiterung kommen; ein 20-40 Sekunden dauernder Stillstand des Blutkreislaufes löst tonische Spasmen, eine Zyanose, und die Fehlfunktion der Schließmuskeln (Miktion, Defäkation) aus; ein über 3 Minuten lang dauernder Stillstand der Herzfunktion lässt die Überlebenschancen drastisch sinken.
Ätiologisch steht beim plötzlichen Herztod meist eine ischämische Herzerkrankung, ein akuter Herzinfarkt, oder ein Herzkammerflimmern im Hintergrund. Weitere Gründe für einen plötzlichen Herztod können entweder vom Herz selber ausgehen (rheumatische Myokarditis, Kardiomyopathie, Herztumore, Herzrhythmusstörungen usw.) oder extrakardial sein (Stoffwechselstörungen, Elektrolytstörungen, Medikamente, eine Thyreotoxikose, die Hyperästhesie des Sinus Karotis, usw.). Die Herzrhythmusstörungen, die ein Adams - Stokes Syndrom verursachen (sog. elektronische Katastrophe) können hypodynamischer Herkunft sein (kompletter AV-Block, teilweiser AV-Block mit Sinusbradykardie), bzw. hyperdynamisch sein (Kammerfibrillation als gefürchtetste Komplikation eines Herzinfarktes, paroxysmale Kammertachykardie).
I./2.5.2.3.3.: Der Herzinfarkt (Infarctus acutus myocardii)
|
 |
In der chronologische Reihe der Aufteilung der wichtigsten Komplikationen einer ischämischen Herzerkrankung würde nun der Herzinfarkt kommen - der Vorgang in der Herzmuskulatur, der zur definitiven und nicht mehr umkehrbaren morphologischen Veränderung, also zum akuten Absterben der Herzmuskulatur (Nekrose) führt -, er wird aber wegen seiner wichtigen Bedeutung in einem separierten Kapitel besprochen.
I./2.5.2.3.4.: Chronisch ischämische Herzerkrankung (sog.cardiopathia ischaemia chronica)
|
 |
Von allen ischämischen Herzerkrankungen führt die chronisch ischämische Herzerkrankung am häufigsten, nämlich in 40 % der Fälle, zum Tode. Mit diesem Begriff - chronisch ischämische Herzerkrankung - meint man alle primär chronisch ischämischen Herzmuskelschädigungen, ausser dem chronischen Herzinfarkt. Letzterer ist eigentlich auch nichts anderes, als die narbige Umstrukturierung der Herzmuskulatur nach einem akuten Infarkt, was heisst, dass es sich hier eigentlich um einen akuten, und nicht um einen chronischen Vorgang handelt; der chronische Teil des Vorganges hier ist also nicht eine Ischämie, sondern eine Reorganisation des Gewebes. Die Ätiopathogenese für die Bildung einer chronisch ischämischen Herzerkrankung ist in erster Linie eine schwere Koronargefässverhärtung.
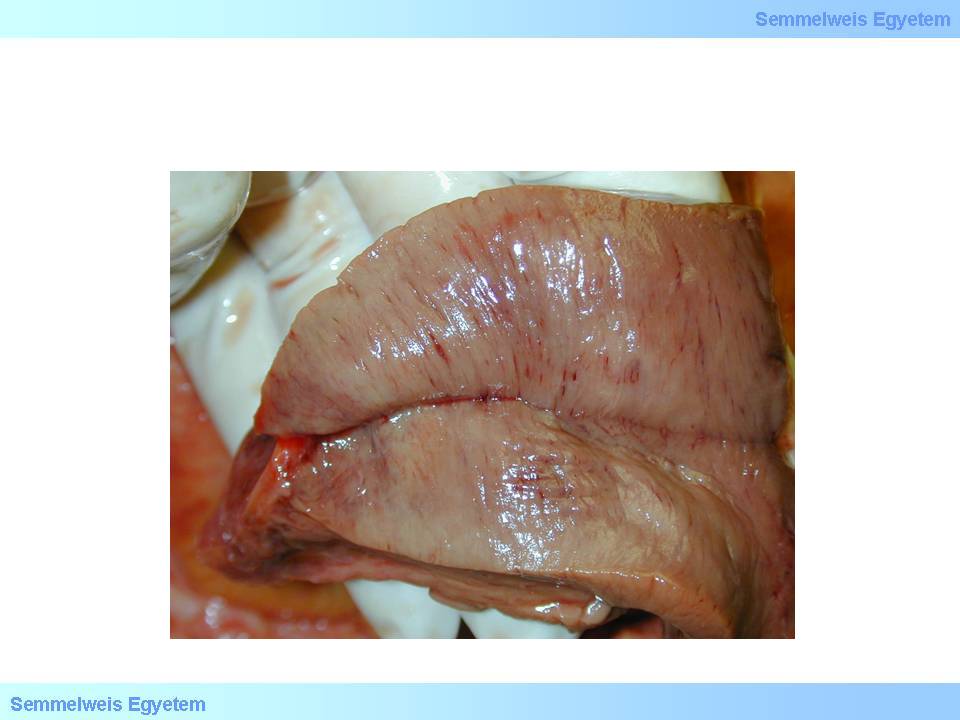
Weitere Gründe für eine chronisch ischämische Herzerkrankung können eine Linksherzhypertrophie (Gewicht des Herzens > 500 g), eine Aorten Hypoplasie, und eine Hypoplasie der Herzkranzgefässe; die alle eine chronische Hypoxie der Herzmuskulatur verursachen. Makroskopisch sieht man sowohl eine Atrophie, eine Normotrophie, als auch eine Hypertrophie (5.Makrofoto.). Auch das histologische Bild ist weitgefächert, da es gleichzeitig aus atrophischen sowie auch aus kompensatorisch hyperplastischen Muskelfasern besteht, Mikroinfarkte (<10 mm) zu sehen sind, fokale Fibrosen und subendokardial gelegene miozytolytische Herde vorkommen können. Bei einer Schädigung der Herzmuskulatur kommt es immer zu einer Koagulationsnekrose oder zu Einzelzell -Nekrosen (sog. Myozytolysen). Der typischste Vertreter der Koagulationsnekrose ist der Herzinfarkt; das atonische Absterben der Muskelfasern (irreversible Relaxation), die Verlängerung der Muskelfasern und eine wellenartige Anordnung Letzterer kommt wegen dem Druck, der auf die Herzkammer von innen ausgeübt wird, zustande (sog.wavy fibers).
|

Beurteilen Sie das Bild!
|
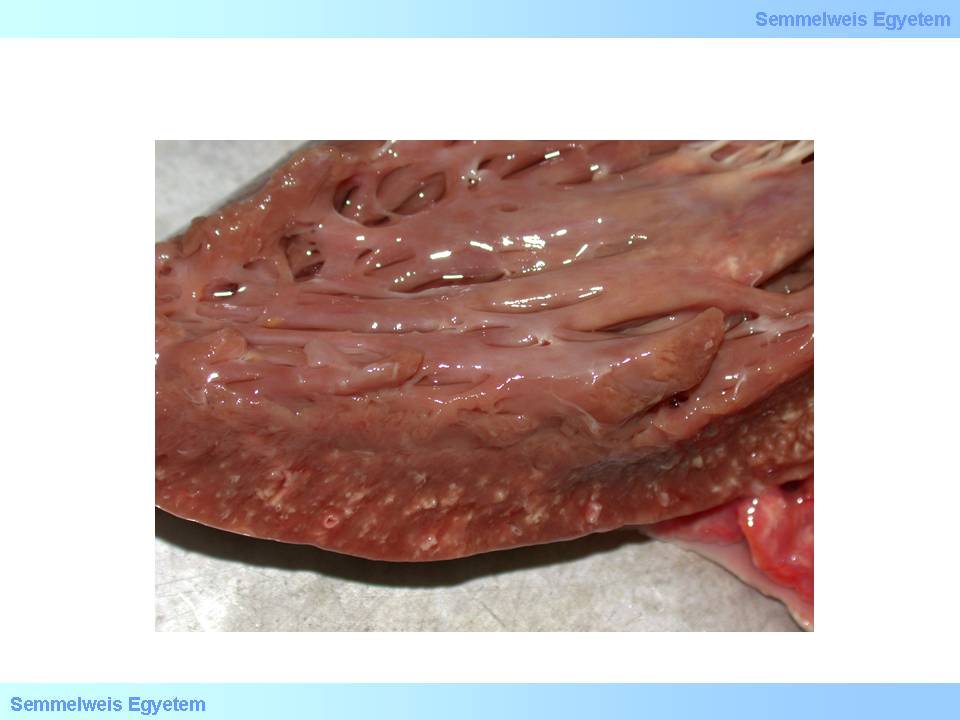
5. Makrofoto: Auf dem Boden einer ischämischen Herzerkrankung ausgebildete myokardiale Fibrose: in der Herzmuskulatur sind unzählige, punktförmige, kleine weisse Narben zu sehen ( Bilderarchiv des II. Pathologischen Institutes der Semmelweis Universität, Budapest).
|
Bei der Kolliquationsmyozytolyse wird das Sarkoplasma der Muskulatur aufgelöst, das myokardiale retikuläre Netz bleibt aber erhalten, was das Gewebe eigentlich zu einem Netz werden lässt. Es ist normalerweise kein Entzündungsinfiltrat zu sehen, und ähnlich der Narbenbildung sieht man auch hier einen Kollaps und die Kondensation des Sarkolemmas und der Muskelfasern, was nicht durch eine aktive Bildung von Fasern zustande gekommen sein konnte. Die Koagulationsmyozytolyse ist weniger häufig, und kommt durch einen metabolisch ausgelösten tetanischen Zelltod, durch eine irreversible Kontraktion der Muskelzellen zustande. Dieses Phänomen sieht man z.B. beim Phäochromozytom und nach einer Herztransplantation oder einen Stromschlag (5A-B. Mikrofoto)
|

Beurteilen Sie das Bild!
|
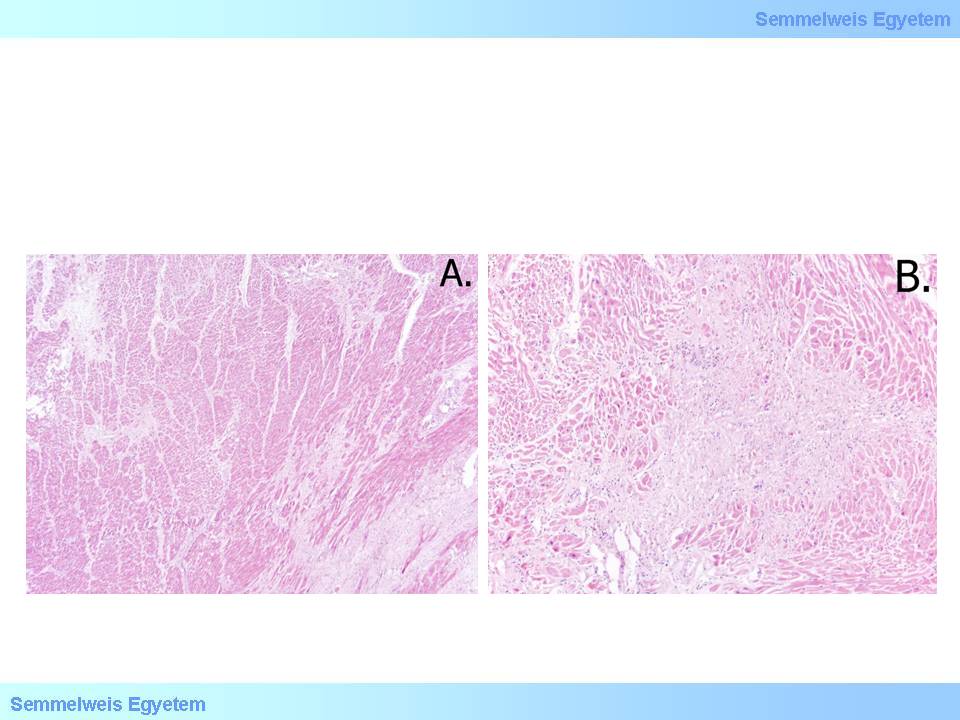
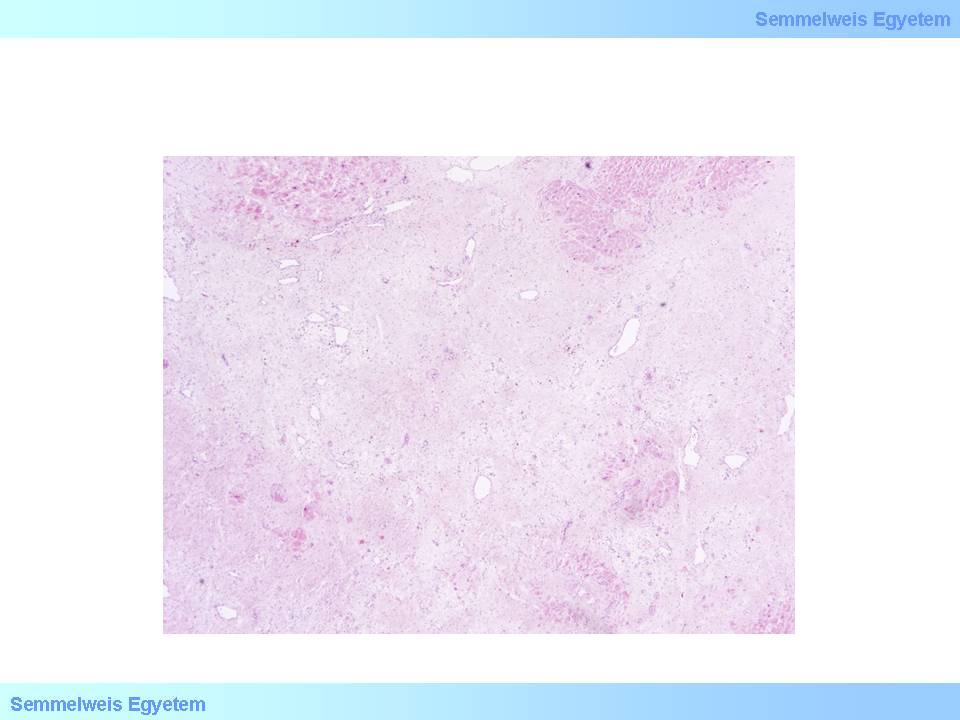
5A-B.Mikrofoto: (HE; A:40x; B:100x;) Bei einer chronisch ischämischen Herzerkrankung ist zwischen den relativ gut erhaltenen Herzmuskelfasern eine interstitielle Fibrose zu sehen (A), bzw. dort, wo irgendwann mal ein Mikroinfarkt stattgefunden hat,sind winzige kleine Narben (B) vorhanden. Die Mikroinfarkte sind <1 cm (Bildarchiv des II. Pathologischen Institutes der Semmelweis Universität, Budapest).
|
I./2.5.3.: Der Herzinfarkt (Herzattacke, infarctus myocardii)
I./2.5.3.1.: Einführung
|
 |
Von einem akuten Herzinfarkt redet man dann wenn die Muskulatur des Herzens in einem umschriebenen Gebiet keine suffiziente Sauerstoffversorgung bekommt, und die Muskelzellen des Herzens innerhalb kürzester Zeit Absterben.
Der Begriff chronischer Herzinfarkt bezeichnet die über 1 cm grosse Narbe, die sich nach einem akuten Herzinfarkt bildet.
In europäischen Durchschnitt sind die 70- bis 80- jährigen am häufigsten betroffen In Ungarn verschiebt sich diese Zahl um ein bis anderthalb Jahrzehnte nach vorne, hier sind nämlich schon die ca. 65 jährigen die typischen Kandidaten für einen herzinfarkt. Die Wahrscheinlichkeit für die Bildung eines letalen, akuten Herzinfarktes ist hier bei uns in Ungarn um das 2 1/2fache höher als im Schnitt in anderen Ländern der EU. Frauen bekommen den ersten Herzinfarkt im Schnitt ca. 8 Jahre später als die Männer, da bei den Frauen die Atherogenese erst nach der Menopause einsetzt, womit eine Frau einem gleichaltrigen Mann gegenüber einen grossen Vorsprung hat, und sich keine ganz so schwere Atherosklerose ausbilden kann.
I./2.5.3.2.: Gründe für die Bildung eines Herzinfarktes
|
 |
Die Gründe für die Bildung eines Herzinfarktes sind die selben, die für eine verminderte Sauerstoffversorgung von Geweben sorgt. Am häufigsten steht eine schwere koronare Gefässverhärtung im Hintergrund, bei der die sog. komplizierten, rupturierten, thrombotisierten, instabilen Plaques dominieren. Eine seltenere Komplikation einer Koronarsklerose ist die Spaltung der Gefässwand (Dissektion - 1 P-4. Mikrofoto). Ätiopathogenetisch kann für Letzteres auch eine Erdheim-sche zystische Mediadegeneration im Rahmen eines Marfan-Syndroms der Auslöser sein. Interessant ist, dass auch schon bei einer mittelschweren Sklerose der Koronargefässe, ein Herzinfarkt zustande kommen kann, wenn ein weiterer ischämischer Risikofaktor hinzukommt; die beiden Faktoren addieren sich und bilden zusammen eine kritische Gefässverengung; der so entstandene Gefässverschluss verursacht dann eine so schwere relative Hypoxie, dass sich eine ischämische Nekrose bildet. Ein möglicher Risikofaktor ist z.B. eine Pneumonie, physikalische Überanstrengung, ein niedriger Sauerstoffpartialdruck der Luft, eine Anämie, oder extremer Stress.
I./2.5.3.3.: Ausbreitung des Herzinfarktes
I./2.5.3.3.1.: Vertikale Ausbreitung des Herzinfarktes
Das Ausmass der Ausbreitung eines Herzinfarktes in die Tiefe - in die Herzmuskelschichten hinein/vertikal -, kann
-
- subendokardial, oder
-
- transmural sein.
|
| |
Subendokardial nennt man einen Herzinfarkt dann, wenn nur die innere Schicht der Herzwand (Subendokardium) betroffen ist.
Das Subendokardium ist die strategische Zone der Herzmuskulatur. Diese Schicht des Herzens ist im ganzen Herzen mit dem größten interstitiellen Druck belastet; dies ist die Schicht, die direkt mit dem Blut in Kontakt tritt, so also unter den Druckverhältnissen funktionieren muss, die in der Herzkammer herrschen. Das bedeutet, dass die subendokardiale Muskelschicht bei der Systole dem höchst möglichen hämodynamischen Druck ausgesetzt ist, und das es bei einer Kontraktion des Herzens in den kleinsten Gefässen sozusagen kein Blutfluss mehr gibt, die Durchblutung des Subendokardiums also quasi abgestellt ist.
Diese Schicht des Myokardiums kommt eingentlich nur in der Diastole zu Blut, bzw. Sauerstoff, wenn durch die Windkesselfunktion der aufsteigenden Aorta und der Herzkranzgefässe der Druck im koronaren Gefässsystem ansteigt, sodass das Subendokardium Übergangsweise nur dem interstitiellen Druck der Diastole widerstehen muss, und so auch Blut in die kleinen Gefässe des Subendokardiumes gelangen kann. Diese Herzmuskelschicht ist ausserdem von den epikardial gelegenen Koronargefässen, die ja die gesamte Herzmuskulatur mit Blut versorgen, am weitesten entfernt gelegen. Ausserdem weiss man, dass die aus dem Epikardium in diese Schicht gelangende Gefässe Endarterien sind, was heisst, dass bei einem eventuellen Stoppen der Blutversorgung - mit Aussnahme einiger weniger subendokardial gelegener Gefässverbindungen - keine Blutversorgung aus benachbarten Gefässgebieten möglich ist.
Der subendokardiale Raum ist also in der sehr schweren Situation, dass er dem größten Druck im ganzen Herzen ausgesetzt ist, am weitesten von der Blutversorgungsquelle entfernt liegt, nicht andauernd, sondern nur zeitweilig mit Blut versorgt werden kann, und fast keine Kollateralen für die Bildung einer Ersatzblutversorgung zustande kommen können. Dies erklärt, dass bei einer Koronarsklerose das Subendokardium als erstes betroffen ist. Der Infarkt dieser Schicht ist makroskopisch ein sich in der innersten Schicht der Herzmuskulatur verbreitender, unregelmäßig geformter, nicht durchbluteter Bereich, dessen Grenzen verschwommen sind. Die Reparation beginnt schon relativ früh- da die abgestorbene Muskelzellschicht relativ dünn ist- , in der ersten Woche nach dem Herzinfarkt; es bildet sich zunächst ein gut durchblutetes Granulationsgewebe, aus dem dann relativ schnell ein sog. subendokardiales Narbengewebe wird. Der sog. wavefront- Mechanismus kann dafür sorgen, dass ein erst nur subendokardial ausgebildeter Herzinfarkt transmural wird.
Bei einem transmuralen Infarkt stirbt die Herzmuskulatur in ihrer gesamten Breite, von der epikardialen bis zur endokardialen Schicht, ab.
Die Ischämie ist in solch einem Falle also so schwer, dass nicht nur die subendokardiale Schicht, sondern die gesamte Herzmuskelwand vom Zellsterben betroffen ist. Bei solch einer ausgeprägteren Schädigung kommt es auch zu mehreren und schwereren Komplikationen.
|
 |
Aus dem oben Besprochenen kann man darauf schliessen, dass es eine isolierte epikardiale Form eines Herzinfarktes überhaupt nicht gibt, weil dessen Ausbildung anatomisch und physiologisch unmöglich wäre.
I./2.5.3.3.2.: Die horizontale Ausbreitung eines Infarktes
Sowohl der subendokardiale, als auch der transmuralen Herzinfarkt können in ihrer Ausbreitung (horizontal) in einem oder zwei Gebieten, oder nur in Teilen eines der drei Hauptversorgungsgebiete der Kranzarterien vorkommen (rechte A. coronaria, Ramus circumflexus, Ramus interventricularis anterior). Je nach dem betroffenen Gebiet können wir topographisch also einen
-
- vorderen (anterior),
-
- seitlichen (lateralen),
-
- oder ein Hinterwandinfarkt (posterior),
-
- einen septalen Infarkt,
-
- bzw. den Infarkt der Herzspitze (apikal)
|
| |
unterscheiden. Bei Infarkten grösseren Ausmasses sieht man Kombinationen dieser topographischen Gebiete (z.B. antero- septaler Infarkt).
Es ist sehr selten, dass alle drei Versorgungsgebiet der Koronarien auf einmal betroffen sind, wobei es sich um eine zirkuläre Ischämie handelt, die vom Pathomechanismus her mit einem Infarkt gleichzusetzen ist, im engeren Sinne aber - per Definitionem - doch kein Infarkt, sondern eine globale Ischämie des gesamten Myokardiums ist, also keine einzelnen Versorgungsgebiete der Koronarien, sondern die gesamte Herzmuskulatur betroffen ist. In solch einem Falle ist die Ätiopathogenese nicht in den Koronararterien, sondern in der allgemeinen Sauerstoffversorgung bzw. in dessen Störung zu suchen: z.B. Lungenentzündung, zu niedriger Sauerstoffgehalt der Luft, Anämie, usw.
|
 |
Beim Vorderwandinfarkt beruht die Ätiologie auf die Stenose/Okklusion des Ramus interventricularis anterior (left anterior descendens- LAD). Hier sind meist die Spitze der Vorderwand und die vorderen 2/3 des Septums betroffen. 40-50% aller Infarkte entstehen hier.
Beim Hinterwandinfarkt beruht die Ätiopathogenese auf die Stenose/Okklusion der rechten Koronararterie (right coronary artery- RCA) oder des Ramus circumflexus (RCX) der Koronararterien. Das infarzerierte Gebiet kann besonders dann sehr gross ausfallen, wenn die das Herz dominierend versorgende Arterie die rechte Kranzarterie ist. Topographisch sehen wir hier eine Infarzerierung an der Hinterwand der linken Kammer, an den hinteren 2/3 des Septums, und eventuell auch an paraseptalen Teilen der rechten hinteren Kammerwand. 20-30 % aller Infarkte bilden sich hier.
Bei den Seitenwand Infarkten ist die Ätiopathogenese in der Stenose/Okklusion des Ramus circumflexus (RCX), bzw. des Ramus marginalis zu suchen. 15-20 % aller Infarkte entstehen in diesem Gebiet.
Bei einem Komplettinfarkt muss es innerhalb kürzester Zeit zu einer Stenose/Okklusion von mindestens 2-3 Hauptästen der Koronarien kommen; dies ist sehr selten.
Der septale Herzinfarkt kommt dann vor, wenn einer der Arterien plötzlich stenotisch/okklusiv verengt wird, die das Septum mit Blut versorgen; dies ist auch sehr selten. Wichtig zu erwähnen ist noch, dass auch ganz kleine Infarkte des oberen Drittels des Septums tödlich enden können, da dieses Gebiet für die Reizweiterleitung zuständig ist (His- Bündel); die danach auftretende elektromechanische Dissoziation führt zu einer sog. malignen Rhythmusstörung. Der transmurale septale Herzinfarkt stört nicht nur die Reizweiterleitung, sondern auch die Pumpfunktion des Herzens; bei einem Riss (ruptura myokardii) kommt es zu einem Links-Rechts-Shunt zwischen den beiden Kammern (infarziöser Septumdefekt) der die Lebenserwartung des Patienten um einiges verschlechtert.
I./2.5.3.4.: Entwicklungsphasen eines Herzinfarktes
-
- nach 30 Minuten: man sieht submikroskopische Veränderungen, die in erster Linie die Kompartimente an der Zellmembran betreffen und durch den Einstrom von Ionen bzw. Wasser zustande kommen, was sich z.B. in der Aufblähung von Mitochondrien und der Bildung von Granula im Zytoplasma bemerkbar macht. Im Blut ist in der frühen Phase des Infarktes - schon 6 Stunden danach - das Serum -Troponin-t und Troponin-i pathologisch erhöht; diese beiden Marker sind spezifisch für die Schädigung der Herzmuskulatur.
|
| |
-
- 5 bis 6 Stunden nach dem Infarkt: man kann die Veränderungen nur mikroskopisch detektieren: die Muskelfasern sind ödematös aufgedunsen, die Querstreifung ist noch erhalten. Die Zellkerne sind blass, aufgebläht, manchmal eingerissen, facettiert. Das Interstitium ist noch unverändert. Makroskopisch sieht man noch keinerlei Veränderungen.
-
- 15 Stunden nach dem Infarkt: jetzt kann man mikroskopisch die abgestorbenen Muskelfasern sehen, die verlängert, verdünnt und gewellt sind. Es erscheinen auch die ersten makroskopisch sichtbaren Veränderungen: das fragliche Gebiet ist blass-gelb, und leicht ödematös (6A.Makrofoto). Bei einem eventuellen Wiedereinsetzen des Blutstromes in den Koronarien (Reperfusion) wird dann das bereits abgestorbene Herzmuskelgebiet sekundär eingeblutet (6B.Makrofoto).
-
- nach 36 Stunden: Makroskopisch sind jetzt die zentralen Gebiete des infarzerierten Bereiches leicht gelb gefärbt. Am Rand ist eine eingeblutete Demarkationszone zu erkennen (7A-B.Makrofoto, 6. Mikrofoto).
|

Beurteilen Sie die Fotos!
|
6A-B.Makrofoto: A: Die häufigste Veränderung nach einem Infarkt ist die gelblich-blasse Verfärbung des abgestorbenen Gebietes. B.: Der hämorrhagische Infarkt ist im Herzen immer sekundär, und bildet sich nur dann aus, wenn der Blutkreislauf zu spät wieder einsetzt (als Ergebnis einer endogenen Thrombolyse oder der den Thrombus auflösenden medikamentösen Behandlung- antithrombotische Therapie), und das wieder einströmende Blut nur noch abgestorbenes Gewebe vorfindet.
|
7A-B. Makrofoto: Das abgestorbene Gebiet wird vom umgebenden Gewebe - als körperfremd erkanntes Material- abgegrenzt. Die makroskopisch am frühesten zu erkennende Veränderung ist die Demarkation, die sich als hyperämischer Ring um das abgestorbene Gebiet herum zeigt.
|
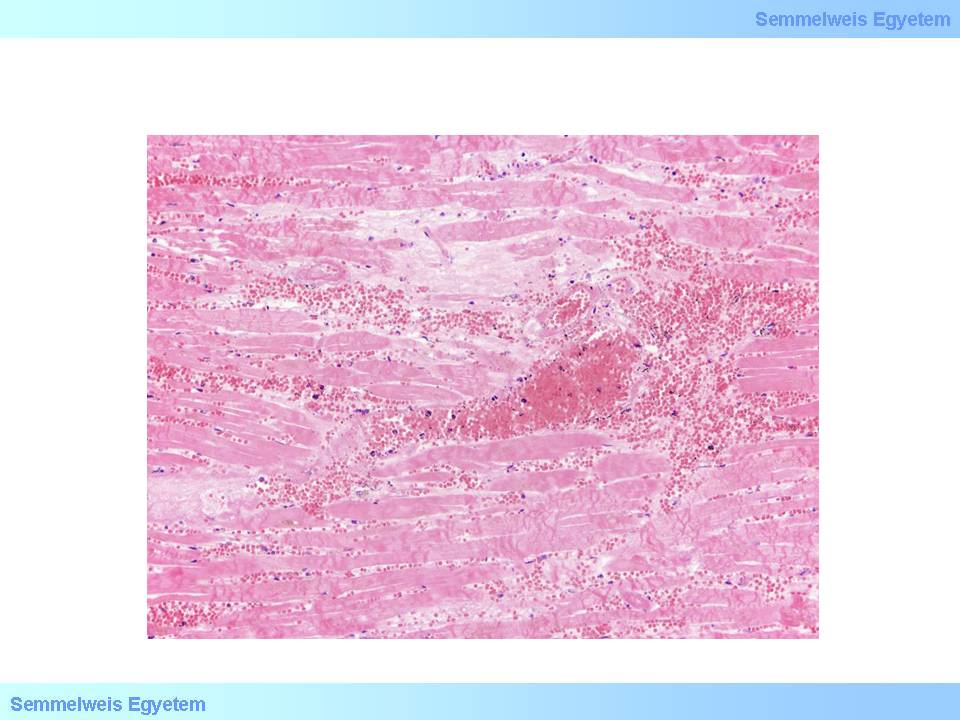
6. Mikrofoto: (HE; 100 x) Mikroskopisches Bild eines sekundär eingebluteten akuten Herzinfarktes. Man sieht mehrere Zeichen, die eindeutig für das Absterben der Herzmuskelzellen sprechen: das Verschwinden der Querstreifung der Muskelzellen, die Ausbildung von breiten kontrahierten Faserbündeln, eine fehlende Kernfärbung, Homogenisierung des Sarkoplasmas. Das Interstitium wird von extravasalen roten Blutkörperchen ausgefüllt.
|
-
- 3-4 Tage nach dem Infarkt: Makroskopisch sieht man nun am infarzerierten Gebiet eine lehmgelbe Färbung, aussen herum ist eine scharf begrenzte, unregelmäßige Demarkationszone (8. Makrofoto) zu sehen. Mikroskopisch bildet sich gleichzeitig (zwischen dem 1. und 5. postinfarktiösen Tag) ein Verlust der Querstreifung der Muskelzellen, ein homogenisiertes und hypereosinophiles Sarkoplasma, und eine verminderte Kernfärbung. Die interstitiellen Bindegewebsfasern brechen auf. Man sieht ein immer stärker werdendes granulozytäres Infiltrat zwischen den abgestorben Muskelzellfasern.
|

Beurteilen Sie das Bild!
|
8.Makrofoto: Einige Tage nach dem Infarkt wird die Demarkation immer schärfer, dass abgestorbene Gebiet wird lehmgelb. Die Randgebiete dieser Demarkation ähneln denen einer dreidimensionalen Landkarte, bzw. sie verlaufen ähnlich wie ein Stand am Meer, weshalb diese Linie als Landkarten-artig bezeichnet wird.
|
-
- nach 1 Woche beginnt der mikroskopisch sichtbare Abtransport der abgestorbenen Zellen durch das Phagozytieren der Makrophagen und es werden einspriessende Fibroblasten erkennbar (9. Makrofoto). Die Gefahr eines Risses in der Herzmuskulatur bzw. einer Herzbeuteltamponade ist jetzt am größten!
9.Makrofoto: Durch die Abräumarbeit der Makrophagen wird das abgestorbenen Gewebe zwischen dem 7. - 10. postinfarktiösen Tag gelb-gräulich verfärbt.
|
-
- nach 2 Wochen sieht man mikroskopisch die Zeichen der Reparatur in Form eines Granulationsgewebes, das zuerst in den Randgebieten erscheint. Die Granulozyten verschwinden, an ihre Stelle werden Lymphozyten, Plasmazellen und eosinophile Granulozyten eingeschwämmt. Makroskopisch wird zur selben Zeit (10. postinfarktiöser Tag) das abgestorbene Gebiet grau, die Demarkationslinie wird immer blasser, das infarzerierte Gebiet wird etwas kleiner.
-
nach 3 Wochen sieht man mikroskopisch nun, dass statt dem Granulationsgewebe ein von Fibroblasten gebildetes, lockeres Bindegewebe vorhanden ist, dessen Fasern mit der Zeit immer mehr werden.
-
nach 6 Wochen ist sowohl mikroskopisch als auch makroskopisch das Endstadium der Reparation, die Narbenbildung zu sehen (10A-C. Makrofoto, 7. Mikrofoto).
|

Beurteilen Sie die Fotos!
|
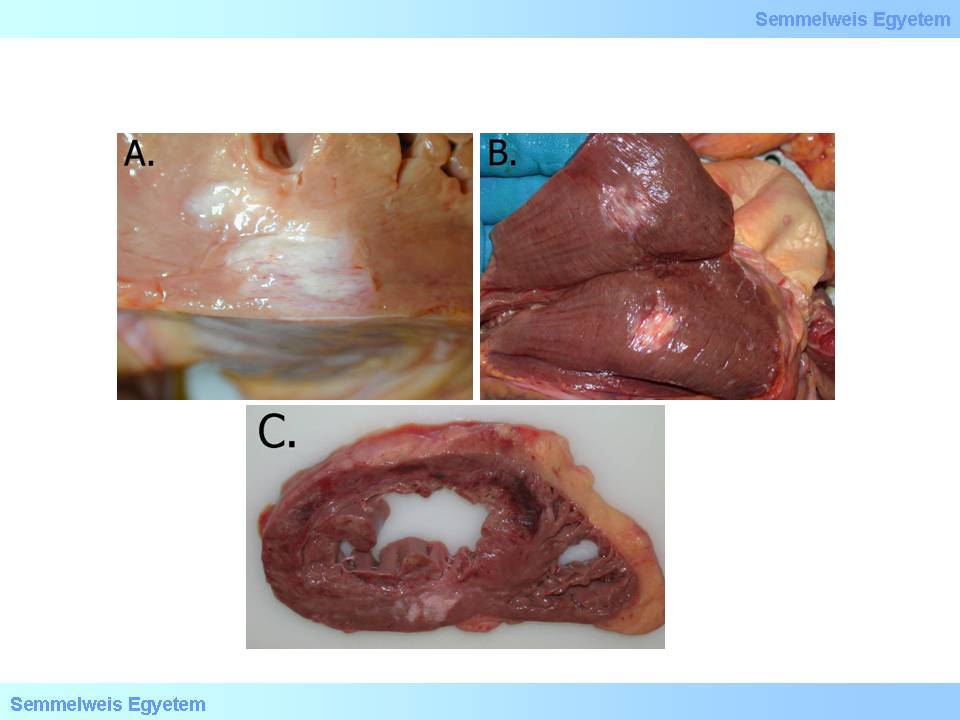
10A-C.Makrofoto: A-B: Das Endstadium der Organisation eines Herzinfarktes ist die Narbenbildung. C: Das eingeblutete Gebiet im oberen Teil des Bildes entspricht einem frischen Herzinfarkt, im unteren Teil des Bildes ist die Narbe nach einem alten Infarkt zu sehen.
|
7. Mikrofoto.: (HE; 100x) Nach einem Infarkt zurückgebliebene grosse Narbe in der Herzmuskulatur.
|
I./2.5.3.5.: Der paradoxe Herzinfarkt
|
| |
Beim paradoxen Herzinfarkt handelt es sich um solch einen Vorgang, bei dem das Mass der Koronarsklerose nicht mit dem im jeweiligen Versorgungsgebiet ablaufenden Infarkt (s. zeitliche Einteilung der Infarkte) übereinstimmt - im versorgenden Gefäss sieht man eine chronische Okklusion, im Versorgungsgebiet des Gefässes ist allerdings ein akuter Infarkt zu sehen. Die Voraussetzung für solch ein Phänomen ist, dass das fragliche Gebiet sehr gut mit Kollateralen versehen ist, die aus den benachbarten Gebieten bis dort hin reichen. So kann es sein, dass bei einem Koronargefässabschnitt ein chronischer Verschluss vorhanden ist, sich dort aber wegen dem vorhandenen Kollateralkreislauf, durch den dieses Gebiet aus dem Nachbargebiet mit Blut versorgt wird, kein Infarkt bildet. Bildet sich dann in der Kranzarterie, die das Nachbargebiet und die Kollateralen des fraglichen Gebietes versorgt hat, ebenfalls eine akute Verengung/ ein akuter Verschluss (z.B. Thrombose), bildet sich im gesamten Gebiet, das von der letztlich verschlossenen Koronararterie versorgt worden ist, ein akuter Infarkt.
I./2.5.3.6.: Der progressive Herzinfarkt
Hierbei handelt es sich um solch einen Herzinfarkt, der sich direkt an der Grenze eines Gebietes befindet, das von einem chronischen Herzinfarkt betroffenen ist. Bei der Ausbildung dieser Art von Infarkt spielt die Störung der perifokalen (periinfartiellen) Mikrozirkulation eine Rolle, bzw. das retrograde Ausweiten der Koronarthrombose im schon einmal verschlossenen Koronargefäss kann auch zu seiner Ausbildung führen. Der Infarkt kann sich mit immer und immer wieder neu anschliessenden Infarktzonen immer weiter vergrössern (sog.wavefront- Erscheinung).
I./2.5.3.7.: Komplikationen eines Herzinfarktes
I./2.5.3.7.1.: Linksherzinsuffizienz und kardiogener Schock
|
| |
Die Pumpfunktion der linken Herzkammer kann als Komplikation eines Herzinfarktes in verschiedenem Masse gestört werden, was von einer leichten Kongestion bis hin zum Zusammenbruch des Kreislaufes (kardiogener Schock) reichen kann. Im infarzerierten Gebiet des Herzens bilden sich in erster Linie Störungen der Kinese - z.B. Hypokinesie (verminderte Bewegungsfähigkeit der Herzkammerwand), oder eine Akinese (kompletter Ausfall der Bewegung der Herzmuskulatur) - aus. Bei einem ausgedehnten Herzinfarkt kann es auch sein, dass das übrig gebliebene funktionsfähige Herzmuskelgewebe einfach zu schwach (insuffizient) dafür ist, um die Pumpfunktion weiter aufrecht zu erhalten. Aber auch bei weniger ausgeprägten Fällen kann eine starke Einschränkung der Herzfunktion, z.B. durch eine sog. elektromechanische Dissoziation, vorkommen. Dies kann dann auftreten, wenn auch schon kleinste Infarkte im oberen Teil des Septums vorkommen, die damit das Bündel betreffen, das die elektronischen Impulse weiterleitet. Unabhängig von der Ätiopathogenese eines Infarktes bedeutet die Ausbildung einer Kammerfibrillation eine große Gefahr, weil dies wegen der kompletten Dissoziation der Herzbewegungen eigentlich mit dem Abschalten der Pumpfunktion des Herzens gleichzusetzen ist.
Ein Herzinfarkt, der mindestens 40 % der Muskelmasse der linken Herzkammer betrifft (1P-11. Makrofoto), hat ganz bestimmt einen kardiogenen Schock zur Folge. Danach befindet sich das kardiovaskuläre System in einer Art Teufelskreis, da die Insuffizienz der Pumpfunktion das Herzzeitvolumen vermindert, wodurch der Sympathikotonus reflexartig erhöht wird, was allerdings wiederum zu einer generalisierten Vasokonstriktion führt, mit der die hämodynamische Belastung des Herzens nur noch weiter wächst, und die Herzinsuffizienz noch weiter verschlimmert wird, was schliesslich dazu führt, dass das Herz stehen bleibt. Klinisch sieht man Dyspnoe, ein sich bis zum Asthma cardiale verschlimmerndes Lungenödem, den Abfall des Blutdruckes, ’kalten Schweiss’ mit Blässe, eine Akrozyanose, Oligurie, und schliesslich die Einschränkung des Bewusstseins bis hin zum Bewusstseinsverlust. Ein kardiogener Schock tritt bei 10 % der Herzinfarkte vor, was i.A. als Komplikation des 2. bzw. 3. Herzanfalles bezeichnet werden kann. Die Sterberate bei einem kardiogenen Schock ist extrem hoch, bei einer sofortigen Behandlung liegt sie bei ca. 80 %, bei einer verspäteten Hilfeleistung beträgt sie 90-100 %.
|

Beurteilen Sie das Bild!
|
11.Makrofoto: Subtotale myokardiale Ischämie. Es kann sehr selten vorkommen – i.A. wegen einer extrakoronaren Ätiopathogenese -, dass sich solch eine extreme Ischämie bildet, die sozusagen das ganze Herz auf einmal betrifft, also nekrotisiert. Ein solch extrem ausgebildeter Verlust des Herzmuskelgewebes ist per Definition eigentlich gar kein Infarkt mehr (sondern eine (sub)totale myokardiale Ischämie), da die für ein Herzinfarkt beschriebene Voraussetzung nicht gegeben ist, dass nur ein bestimmtes Gebiet, das zu einem der das Herz versorgenden Koronargefässe eingeordnet werden kann, betroffen ist. Klinisch sieht man in solch einem Fall einen kardiogenen Schock.
|
I./2.5.3.7.2.: Aneurysma der linken Herzkammer
Bei jeglicher Art von Ausstülpungen der Kammerwand des Herzens redet man von einem Aneurysma. Diese Erscheinung geht Hand in Hand mit der Verdünnung der Herzkammerwand einher. Nach einem Herzinfarkt kommt es in 15 % der Fälle zu solch einer Veränderung. Pathophysiologisch steht die verminderte Widerstandsfähigkeit des inkarzerierten Herzmuskelgewebes bzw. die des ponstinfarktiösen Narbengewebes im Hintergrund; je weniger widerstandsfähig die Herzwand ist, desto stärker ist die sich bildende Ausstülpung des Aneurysmas. Ein akutes Aneurysma der Herzkammerwand (12A. Makrofoto) entsteht im Stadium des akuten Infarktes, in der ersten postinfarktiösen Woche, in der die Makrophagen anfangen, das abgestorbenen Gewebe abzutransportieren, was eben gerade deshalb oft sogar zum Einreissen der Kammerwand führt.
|

Beurteilen Sie die Fotos!
|
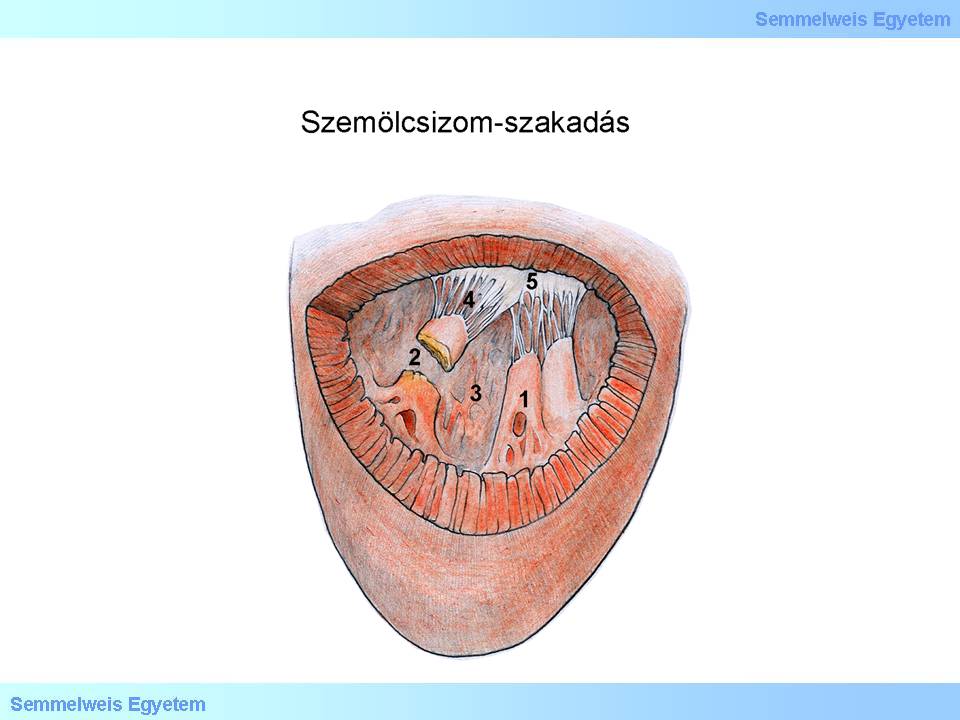
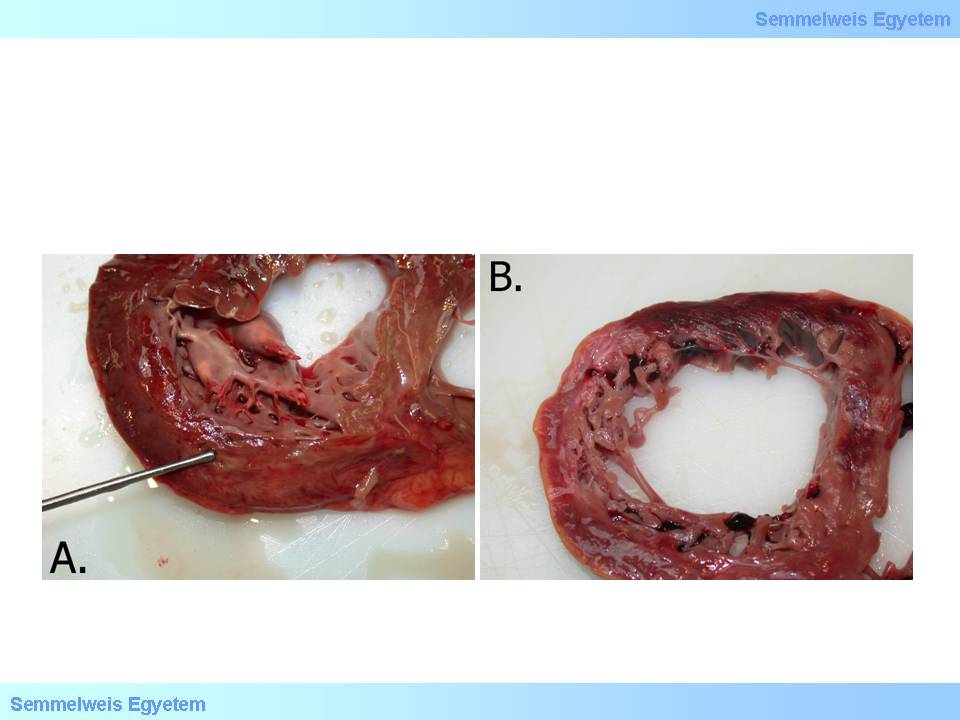
Abbildung 1:Aneurysma der linken Kammerwand. (1)Aorta; (2)Atrium sinistrum; (3)Aneurysma; (4)Ventriculus sinister; (5)Ventriculus dexter; (6)Septum interventriculare; (7)Vorderansicht; (8)Ansicht von unten;
|
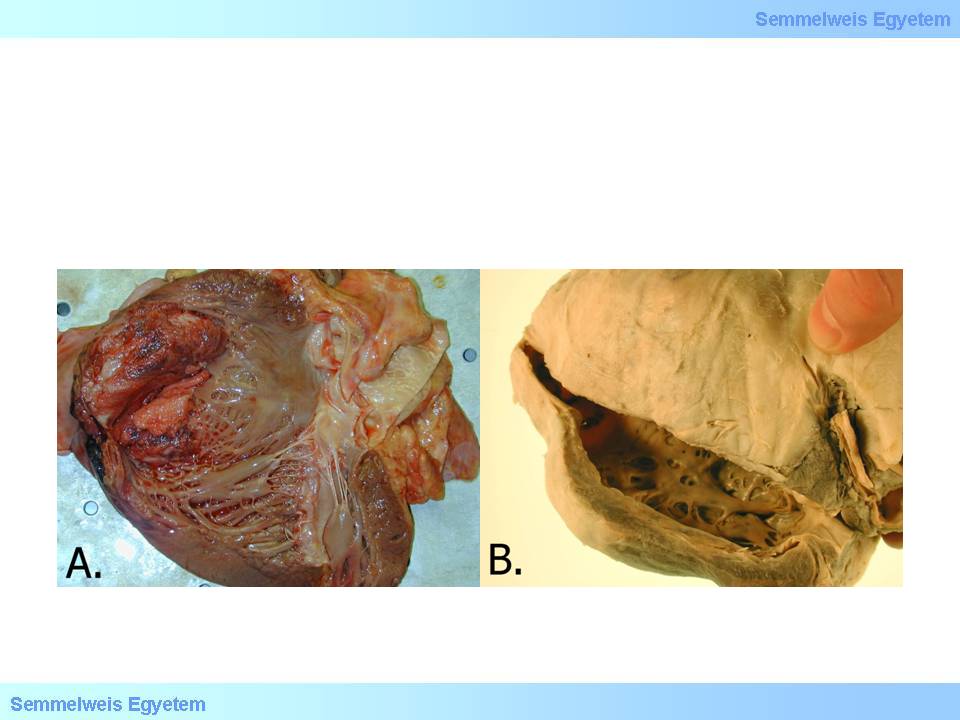
12A-B.Makrofoto: A: Mehrere Thromben an der Herzkammerwand nach einem frischen Herzinfarkt. Das Septum des Herzens und die Herzspitze sind verdünnt und ausgestülpt, was auf die Bildung eines akuten Aneurysmas der linken Herzkammerwand hindeutet. B: Chronisches Aneurysma der linken Herzspitze. Man sieht, dass die Herzspitze dermassen verdünnt ist, dass das Licht hindurch scheinen kann; die Wand ist aber Dank ihrer festen bindegewebigen Zusammensetzung so widerstandsfähig, dass spontane Risse so gut wie nie vorkommen. Die Ausstülpung dieses Kammerwandabschnittes kommt wegen der chronischen Volumenbelastung, die das Blut auf die Herzwand ausübt, zustande.
|
Ein chronisches Aneurysma der Herzkammerwand (12B.Makrofoto) kann sich noch Monate - Jahre nach einem Infarkt, der mit einer Infarktnarbe geheilt ist, bilden; dieser Vorgang kann mit der passiven Reaktion des Narbengewebes auf die hämodynamische Belastung hin erklärt werden. Bei grossen Aneurysmen sieht man die sog. paradoxe Pulsation, was soviel bedeutet, dass sich das Aneurysma nicht gleichzeitig mit der Herzmuskulatur, sondern nach ihr füllt. Der Inhalt der Herzkammern wird in solch einem Fall zwischen der Kammer und dem Aneurysma hin und her bewegt, was den sowieso geschädigten Herzmuskel noch mehr belastet. Der ohnehin verlangsamte und immer mehr überlastete Koronarkreislauf wird somit nochmals verringert, und die Linksherzinsuffizienz verschlechtert sich. Eine häufige Komplikation der Aneurysmen ist die Thrombenbildung im Aneurysma selber (ca. 50 %). In 5 % der Fälle wird solch ein Fragment abgerissen, und es kommt zu einer Embolisation.
I./2.5.3.7.3.: Ruptur der Herzkammerwand, perikardialer Bluterguss - Herztamponade (haemopericardium)
|
| |
Bei 10-20 % der tödlich endenden transmuralen Herzinfarkte bildet sich zwischen dem 3. und 5. postinfarktiösen Tag ein Riss in der vom Infarkt betroffenen Kammerwand. Der Riss in der Herzkammer führt schnell dazu, dass sich der Herzbeutel mit Blut füllt, und diese plötzlich auftretende, frische perikardiale Blutansammlung verhindert dann (Tamponade - 13. Makrofoto) - wegen der Unfähigkeit des Perikardiums, zu dilatieren-, dass das Herz in der Diastole dilatiert wird, und so das Herz eigentlich Wort wörtlich zusammengedrückt (gewürgt) wird; der plötzliche Herztod stellt sich dann schliesslich wegen dieser speziellen Form der elektromechanischen Dissoziation des Herzens ein. Bei Letzterem handelt es sich also um eine Insuffizienz der Pumpfunktion des Herzens, die nicht auf eine ungenügende Weiterleitung der mechanischen Reize und deren ungenügende Verschaltung mit der Herzmuskulatur zurückzuführen ist, sondern bei erhaltener Verschaltung der Herzmuskulatur und dem Leitungssystem des Herzens durch einen äusseren pathologischen Mechanismus zur Asystole führt.
|

Beurteilen Sie das Bild!
|
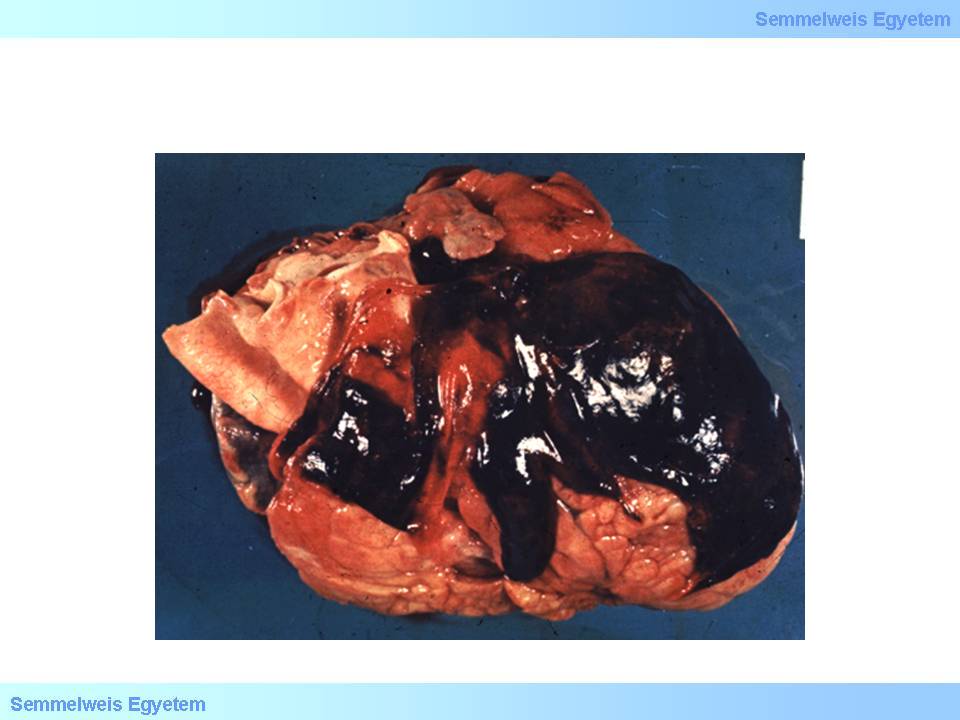
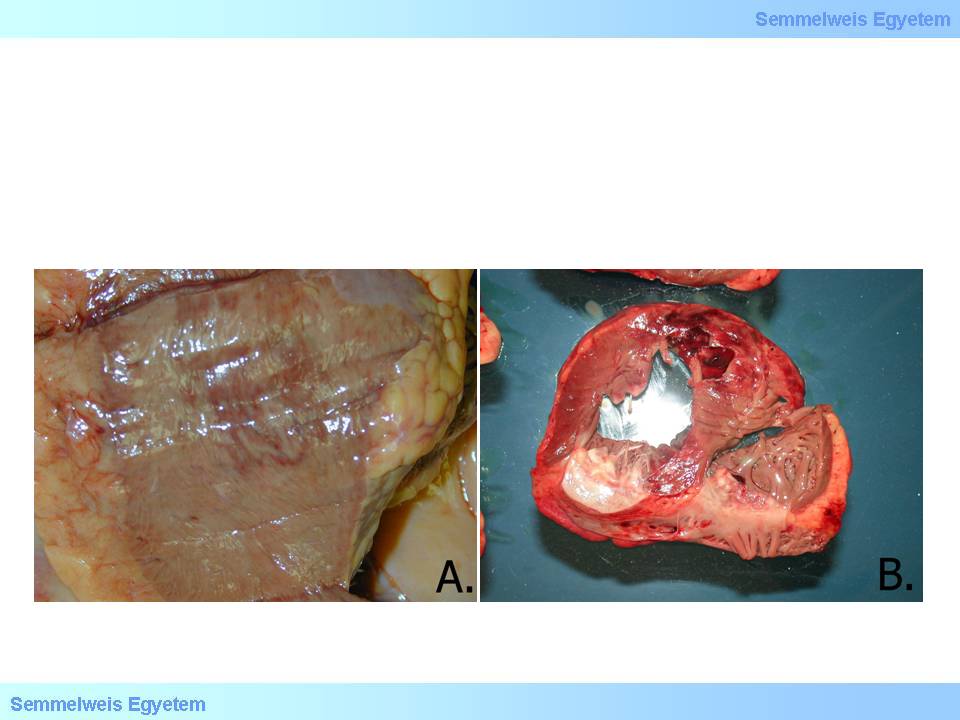
13.Makrofoto: Perikardialer Bluterguss, Hämoperikardium, Herzbeuteltamponade - diese Ausdrücke werden synonym benutzt, und zeigen, wie das in den Herzbeutel einströmende Blut die Funktion des Herzens stoppt.
|
Die Geschwindigkeit, mit der Sicht das Perikard mit Blut füllt, hat einen grossen Einfluss auf die Lebenserwartung des Patienten. Bei grossen Rissen gelangt schnell viel Blut (20- 50 ml) ins Perikard, was schon tödlich sein kann; ist der Riss in der Wand nicht ganz so groß, und zieht sich die Füllung des Perikardiums, kann noch eingegriffen werden: das Blut kann abgesaugt werden, oder es kann operativ eingegriffen werden. Man muss an dieser Stelle bemerken, dass auch andere Flüssigkeiten als Blut eine Herzbeuteltamponade verursachen können: der Erguss bei einer Perikarditis, das bei einer chronischen Herzinsuffizienz im perikardialen Beutel erscheinende Transsudat, bzw. eine blutig-seröse Flüssigkeit bei Tumormetastasen (pericarditis carcinomatosa, carcinosis perikardii) können die Perikardhöhle auch füllen. Diese Flüssigkeiten gelangen aber bloss langsam, Stück für Stück ins Pericard, und werden von den Patient so besser (sogar bis zu 80-100 ml) toleriert. Gründe für ein erhöhtes Risiko einer Herzkammerruptur: transmuraler Herzinfarkt, akutes Herzwandaneurysma; hohes Lebensalter; weibliches Geschlecht; Steroidtherapie; erhöhter Blutdruck; gering ausgebildeter Kollateralkreislauf; Herzmuskel Fibrose.
|

Beurteilen Sie das Bild!
|
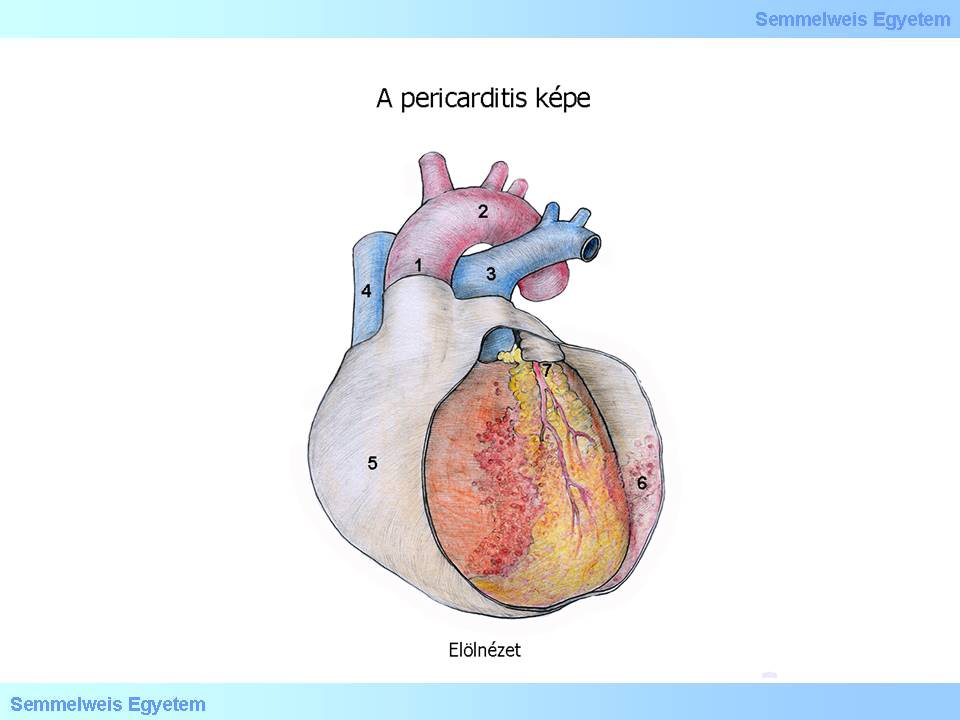
Abbildung 3: Exsudat einer Perikaditis (1)Aorta ascendens; (2)Arcus aortae; (3)Truncus pulmonalis; (4)Vena cava superior; (5)Perikardium; (6)Exsudatum; (7)Arteria interventricularis anterior; (8)Ansicht von vorne.
|
I./2.5.3.7.4.: Einriss der Septumwand
Diese Komplikation bildet sich bei 1-2 % der Patienten mit einem Herzinfarkt, typischerweise zwischen dem 2. und dem 4. postinfarktiösen Tag. Das klinische Bild ist äusserst markant: es kommt zu einem anginösen Anfall, Hypotension, zu einer akuten Herzinsuffizienz, oder sogar zu einem kardiogenen Schock. Der bei einem Septumdefekt vorkommende Links-Rechts-Shunt wird schnell zu einer Linksherzinsuffizienz, der eine Insuffizienz des rechten Herzens folgt. Bei komplizierten Fällen, wo das Reizübertragungssystems mit beschädigt sein kann, ist auch die Pumpfunktion des Herzens beeinträchtigt (14.Makrofoto)
|

Beurteilen Sie das Bild!
|
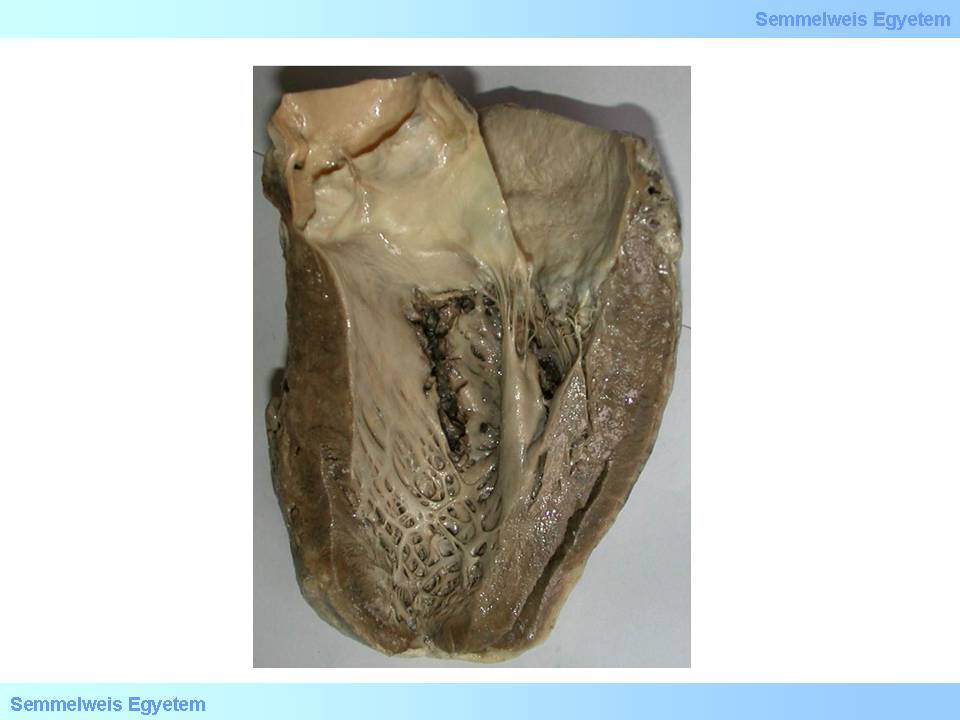
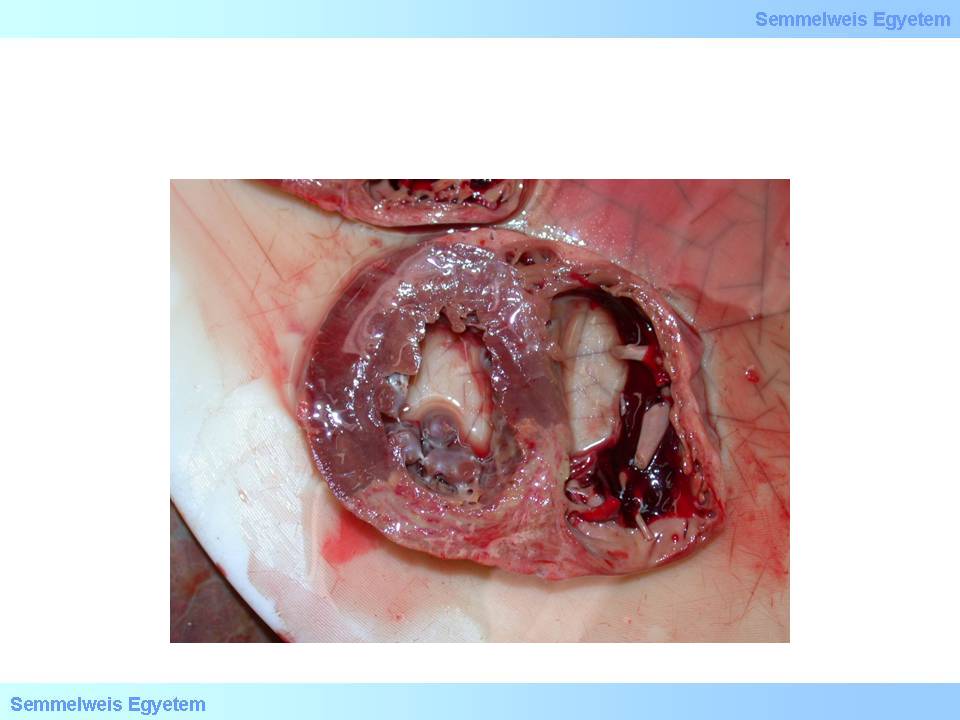
14.Makrofoto: Ruptur des septalen Myokardiums. Als Komplikation treten ein plötzlicher Links-Rechts-Shunt und Störungen der Reizweiterleitung auf.
|
I./2.5.3.7.5.: Dysfunktion und Risse der Papillarmuskeln
Die Papillarmuskulatur bildet sowohl metabolisch, als auch pathophysiologisch und pathologisch einen Teil des Subendokardiums; Funktionsstörungen Letzterer können schon bei einer Angina pectoris aufgezeigt werden. Bei einem Infarkt kommt es zu Schäden der Papillarmuskulatur- am häufigsten zwischen dem 2. und 7. postinfarktiösen Tag. Der Riss der Papillarmuskeln, bzw. ihrer Sehnenfäden (15. Makrofoto) bedeutet Lebensgefahr: es kann sich ein plötzlicher schwerer Klappenfehler (Mitralinsuffizienz) und sogar eine Herzinsuffizienz ausbilden, die einen akuten operativen Klappenersatz nötig machen.
|

Beurteilen Sie das Bild!
|
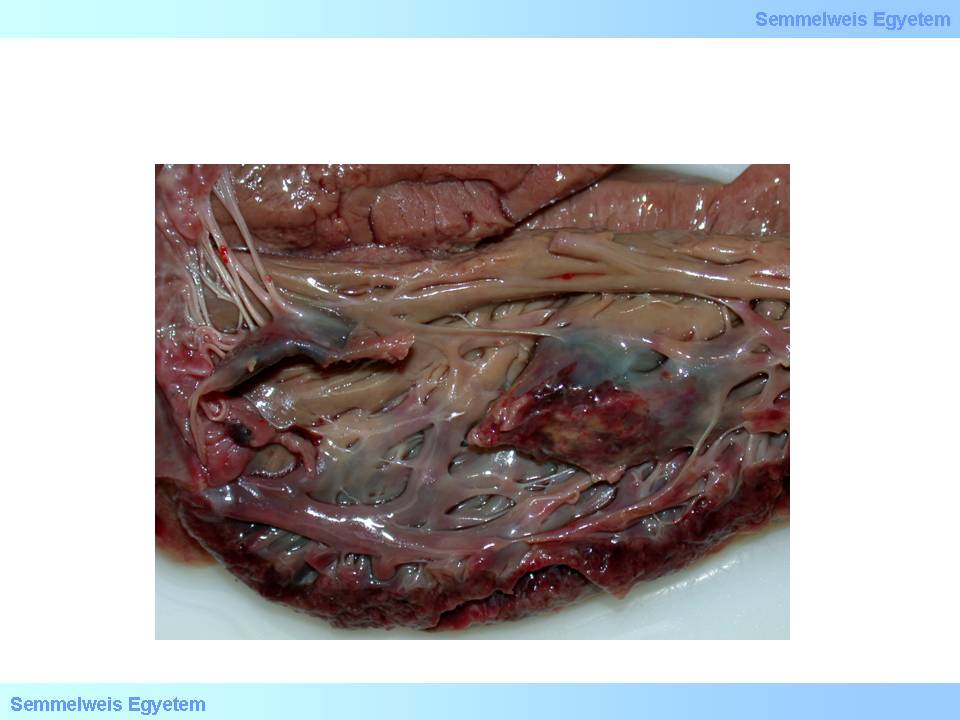
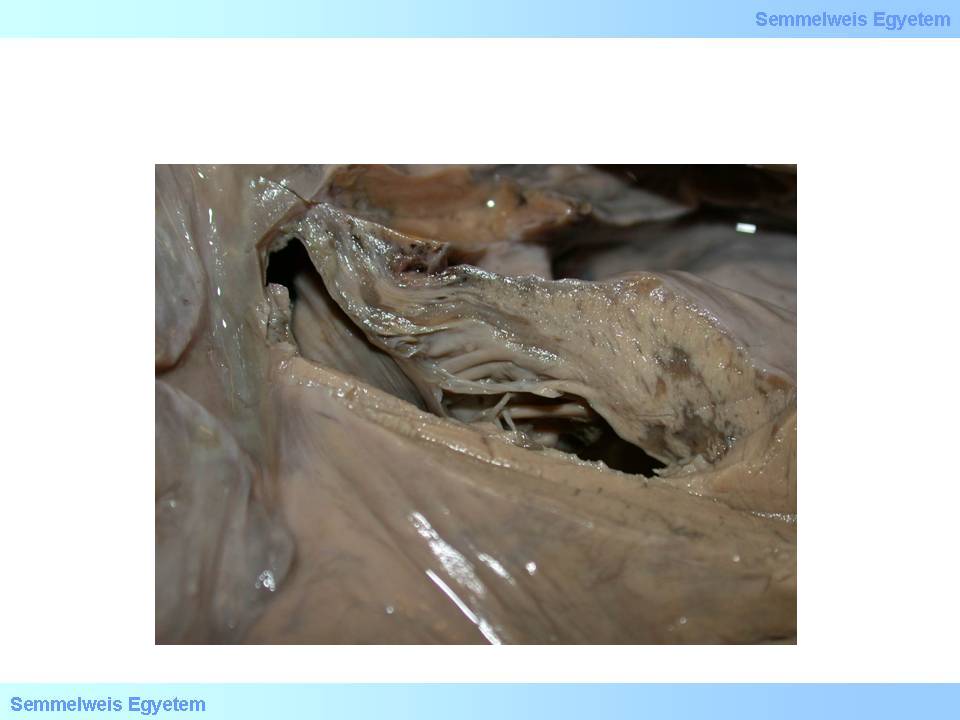
15.Makrofoto: Ruptur eines Papillarmuskels: eine plötzliche, schwere Komplikation eines Infarktes, die eine Funktionsstörung der Mitralklappen mit sich bringt.
|

Abbildung 2: Ruptur eines Papillarmuskels (1)Musculi papillares; (2)Ruptura musculus papillaris; (3)Ventriculus sinister; (4)Chorda tendinae; (5)Valvula mitralis.
|
|
|