|
|
V./1.4. Klinikai kutatások
Meghatározás
A klinikai kutatások emberen végzett szabályozott vizsgálatok, amelyek célja diagnosztikus, terápiás, megelőzési és rehabilitációs eljárások kidolgozása, továbbfejlesztése, valamint élettani, kórélettani folyamatok feltárása.
Típusok
|

Milyen típusai vannak az élő személyeken végzett terápiás indíttatású vizsgálatoknak?
|
A klinikai kutatások a vizsgálati alany élettani állapota szempontjából történhetnek elhunyt (kórbonctani kutatások) és élő személyeken. A továbbiakban az élő személyeken végzett klinikai kutatásokra fókuszálunk, és azokon belül is a terápiás indíttatású vizsgálatokra, amelyek lehetnek
-
A.) sebészeti, eszközös vizsgálatok,
-
B.) nem gyógyszeres, terápiás eljárások vizsgálata (pl. balneoterápia, klímaterápia),
-
C.) gyógyszeres vizsgálatok.
Ez utóbbiak ismét feloszthatók
-
a.) gyógyszerfejlesztési kutatásokra és
-
b.) gyógyszeralkalmazási klinikai vizsgálatokra.
A gyógyszerfejlesztést célzó klinikai kutatások alatt a gyógyszeripari, a forgalomba hozatali engedély megszerzését (népszerűen: törzskönyvezést) célzó klinika vizsgálatokat értjük. A gyógyszerterápiás vizsgálatok ipari és/vagy akadémiai indíttatásúak, és forgalomba hozatali engedéllyel rendelkező gyógyszerekre, illetve azok kombinációira vonatkoznak. Nézzük meg őket közelebbről!
Gyógyszerfejlesztési (ipari) klinikai kutatások
Ezek a kutatások az ún. klinika előtti (preklinikai) vizsgálatok sikeres kimenetele esetén indulhatnak el. Ebben a szakaszban már kellő kémiai, farmakológiai, biztonságossági és gyógyszertechnológiai, dokumentált ismeretekkel rendelkezünk ahhoz, hogy a leendő gyógyszert – amely ebben a szakaszban még csak vizsgálati készítménynek nevezhető – emberi szervezetbe juttassuk. A jó dokumentáltság hatósági szempontból kiemelkedő fontosságú, és meg kell felelnie a
-
A.) Good Laboratory Practice (GLP, Helyes Laboratóriumi Gyakorlat)
-
B.) Good Manufacturing Practice (GMP, Helyes Gyártási Gyakorlat)
előírásainak. Az utóbbi a kiszerelt vizsgálati készítmény előállítására vonatkozik. A klinikai vizsgálatok fő fázisai:
|

Melyek a klinikai vizsgálatok fő fázisai, és mi az egyes fázisokban végzett vizsgálatok célja?
|
-
A.) fázis I. vizsgálatok
-
B.) fázis II. vizsgálatok
-
C.) fázis III. vizsgálatok
-
D.) fázis IV. vizsgálatok
A fázis I vizsgálatok jellemzően egészséges önkénteseken végzett vizsgálatok, amelyeknek elsődleges célja humán farmakokinetikai és biztonságossági adatok megszerzése. Vannak azonban olyan esetek (kiemelten onkológiai), ahol a fázis I vizsgálatokban betegek vesznek részt, mivel az egészséges önkéntes szervezetét etikai okokból sem tehetjük ki az óhatatlanul toxikus szerek okozta kockázatnak. A fázis II vizsgálatok betegeken végzett vizsgálatok, ahol a fő cél a megcélzott terápiás hatás első igazolása (Proof of Concept, POC), tájékozódó jellegű kinetikai és biztonságossági adatok megszerzése, a terápiás dózis pontosítása. A fázis III vizsgálatok a fázis II vizsgálatok eredményeinek megerősítésére szolgálnak (konfirmatív vizsgálatok).
A fázis I vizsgálatokban 10-100 fő, a fázis II-ben 40-200 fő, a fázis III-ban több ezer fő vesz részt tipikusan. Újabban fázis 0 (nulladik fázis) vizsgálatokat is végeznek, általában 10 alatti számú egészséges önkéntesen. Ezekben az esetekben a mikrodózisban adott szer élettani hatását vizsgálják megfelelő biomarkerek (vér- és szövetmintából, képalkotó eljárással nyert adatok) követése révén.
|

Milyen szempontból szabályozza a GCP és a Helsinki Deklaráció a klinikai fázis vizsgálatokat?
|
A fázis IV vizsgálatok a forgalomba hozatali engedély megadása után végzett klinikai vizsgálatok, amelyek célja széles populációban szerzett terápiás, interakciós stb. adatok gyűjtése. A vizsgálatok csak a forgalomba hozatali engedélyben felsorolt indikációkban végezhetők. Ezektől eltérő indikáció esetén a szponzornak fázis II és/vagy fázis III vizsgálatokat kell kezdenie. Az említett klinikai fázis vizsgálatok fő szabályozói:
-
A.) Good Clinical Practice (GCP, Helyes Klinikai Gyakorlat),
-
B.) Helsinki Deklaráció és annak frissített változatai (legutolsó: Szöul 2008).
A GCP elsősorban a szakmailag korrekt és egymással összehasonlítható vizsgálati kivitelezést teszi lehetővé, és egyúttal védi mind a megbízó, mind a vizsgáló személyzet, mind pedig a vizsgálati alany (férfi, nő, gyermek) érdekeit jogi és biológiai értelemben egyaránt. A Helsinki Deklaráció az etikai szabályozás alapelve. Aki nem tartja szem előtt a fenti két szabályozót, az elbukik a hatósági szakaszban, nem beszélve a jogi és anyagi következményekről.
A két fő szabályozó mentén az egyes országok saját hatósági eljárásaikat is kidolgozták. Ezek országonként és földrészenként némileg eltérőek, de törekvés van a harmonizációra a vizsgálatok fölösleges ismételgetésének elkerülése érdekében. Hazánkban az alábbi törvényi, rendeleti szabályozások érvényesek jelen szakasz írásakor:
|

Hazánkban mely törvényi, rendeleti szabályozások érvényesek a klinikai vizsgálatokra vonatkozóan?
|
-
A.) az 1997. évi CLIV. törvény az egészségügyről,
-
B.) a 2005. évi XC. törvény az emberi felhasználásra kerülő gyógyszerekről,
-
C.) a 235/2009 kormányrendelet az emberen végzett orvostudományi kutatások szabályairól,
-
D.) a 32/2009 EüM rendelet az emberi felhasználásra kerülő vizsgálati készítmények klinikai vizsgálatáról és a helyes klinikai gyakorlat alkalmazásáról.
A fázisvizsgálatok fő szereplői:
-
A.) a szponzor (megbízó, jellemzően ipari szereplő),
-
B.) a vizsgáló (vizsgálati hely, személyzet, kisegítő egységek, klinikai vizsgálatszervező vállalkozások stb.),
-
C.) vizsgálati alany (egészséges, beteg, férfi, nő és gyermek).
A vizsgálat egészéért jogilag a szponzor felelős. A vizsgálatok folyhatnak egy (tipikusan fázis 0 és fázis I) vagy több vizsgálóhelyen. A fázis II és fázis III vizsgálatok általában több országban és országonként is több helyszínen valósulnak meg. A fázis IV vizsgálatok szintén több vizsgálóhelyen zajlanak, de adott esetben csak egy országra korlátozódnak. Hogy hol, milyen vizsgálati alanyokon folynak a vizsgálatok, azt befolyásolja annak
-
A.) jellege, elrendezése,
-
B.) a gyógyítandó betegség jellemzői,
-
C.) a terápiás hatás bizonyításához szükséges létszám (statisztikai erő).
A vizsgálati elrendezés tekintetében meg kell jegyezzük, hogy bizonyítékot (evidencia, Evidence Based Medicine) a terápiás hatásra csak az előremenő (prospektív), randomizált (véletlenszerűen csoportba osztott vizsgálati alanyok), dupla vak (vagy másként: maszkolt, azaz sem a vizsgálat végzője, sem alanya nem tudja, hogy mit kap adott esetben) placebo - vagy aktív („golden standard” gyógyszer) kontrollos vizsgálatok (RCT, Randomized Controlled Clinical Trial ) adhatnak Általánosan elfogadott gyakorlat, hogy az egészséges önkéntesek megfelelő mértékű (de semmiképp sem ösztönző jellegű) díjazásban részesülnek. A betegek megkaphatják a munkából való kiesésük, utazásuk stb. költségeinek térítését, a gyógyulás esélyét, valamint gondos egészségügyi kontrollt „cserébe”. Ez a kérdéskör természetesen etikailag igen kényes. Fontos megjegyeznünk, hogy minden egyes vizsgálatnak biztosító által biztosítottnak kell lennie, az állami garancia nem elegendő.
|

Mit értünk bioekvivalencia vizsgálatok alatt?
|
Az eddig említettek az eredeti gyógyszerek fejlesztését érintették. Meg kell jegyezzük, hogy a biotechnológia fejlődése révén ma már szembe kell néznünk az élő szervezetek (baktériumok, emlőssejtek) által előállított fehérjetermészetű hatóanyagok fejlesztése szabályozásának kérdéseivel is. Ezek az ún. biologikumok igen hatásosak gyulladásos és onkológiai kórképek kezelésében, és újabb terápiás területek is nyílnak napról-napra. E szerek azonban jellemzőikben nagymértékben eltérnek a hagyományos, szintetikus kémiai úton előállított ún. kis molekuláktól biztonságossági szempontból is. A fejlesztést elősegítő nemzetközi irányelvek kidolgozása folyamatos.
Az eredeti gyógyszerek kutatás-fejlesztése mellett generikus (a népnyelvben: lejárt szabadalmú) készítmények vizsgálata, a forgalomba hozatali engedély megszerzése is klinikai vizsgálatot követel a gyártótól. Ezek a bioekvivalencia vizsgálatok. Hazánkban e vizsgálatok fázis I vizsgálatnak számítanak, és csak az Országos Gyógyszerészeti Intézet (OGYI) által akkreditált klinikai farmakológiai fázis I vizsgálóhelyeken végezhetők. A vizsgálati alanyok tipikusan egészséges önkéntesek, de lehetnek betegek is.
|

Az Országos Gyógyszerészeti Intézet (OGYI) 1962-ben jött létre az Egészségügyi Minisztérium Műszaki Fejlesztési osztályából.
|
Jellemző elrendezés, hogy a vizsgálati alanyok egyik alkalommal az egyik (teszt vagy összehasonlító, ”komparátor” szer) máskor pedig a másik (teszt vagy komparátor szert) kapják meg megfelelő kiürülési (kimosási) idő után. A komparátor szer lehet az originátor készítménye vagy egy már piacon lévő generikus készítmény, a teszt szer mindig a generikumát forgalomba hozni óhajtó szponzoré. Ha a kinetikai paraméterek ( max /maximális plazmakoncentráció és AUC/Area Under Curve, görbe alatti terület) bizonyos határon belül megközelítőleg együtt vannak, akkor a generikus készítmény a komparátor szerrel biológiailag egyenértékű (ekvivalens). A határsáv 80-125%. Ha pedig a készítmény kinetikailag ekvivalens, akkor terápiásan is egyenértékű és helyettesítheti a komparátor készítményt. Ez piaci szempontból is igen fontos rendelkezés.
Említettük korábban a biologikumokat. Az eredeti szabadalmak lejártával sorra jönnek ki a generikus, kedvelt terminológiával biológiailag hasonlónak (biosimilar) nevezett készítmények. Itt a lényeg a fehérjetermészetből következő hasonlóság (tehát nem azonosság, mint a szintetikus kis molekulák esetében). Ebből számos probléma fakad, főleg az immunogenitás terén. A hatósági irányelvek kidolgozása most van folyamatban, de azt látni kell, hogy ezen bioszimiláris generikus készítmények esetében bizonyos preklinikai és terápiás vizsgálatokat is el kell végeznie a szponzornak, a hagyományos bioekvivalencia vizsgálat nem jön szóba.
A gyógyszerfejlesztési klinikai kutatások ipari-szervezési jellemzői és kihívásai
A klinikai gyógyszerfejlesztési kutatás rendkívül komplex feladat. Ez egyben azt is jelenti, hogy sikeres végrehajtásához jó csapatmunka szükséges. A csapatmunka fő szereplői az alábbiak:
|

Kik a gyógyszerfejlesztési klinikai kutatások fő szereplői?
|
-
A.) a szponzor belső szakértő- és döntéshozó csoportjai (management, minőségbiztosító egységek, projekt-teamek, szabadalmi és törzskönyvezési szakemberek stb.),
-
B.) szerződött külső klinikai kutatásszervező vállalkozások (Contract Research Organisation, CRO stb.),
-
C.) a klinikai vizsgálatot irányító testület (Steering Committee),
-
D.) a klinikai vizsgálatot vezető szakember (Principal Investigator),
-
E.) a klinikai vizsgálóhely(ek),
-
F.) etikai bizottság(ok),
-
G.) hatóság.
Az összes érintett szervezeti egység munkatársainak szakmai tudása, emberi hozzáállása, kapcsolatteremtő és -tartó képessége, az elvégzendő feladatok iránti teljes elkötelezettsége éppúgy elengedhetetlen, mint a megfelelő infrastrukturális és informatikai háttér. Mindez a teljes láncolatra érvényes.
A klinikai kutatásban résztvevőknek célszerű szem előtt tartani a gyógyszeripari K+F néhány alapvető jellemzőjét:
-
A.) időigényes,
-
B.) költséges,
-
C.) alacsony a sikerráta.
Vegyük ezeket sorra.
-
A.) Időigényesség: egy eredeti gyógyszermolekula piacra viteléhez átlagosan 10-12, esetleg 15 év szükséges (1. ábra)
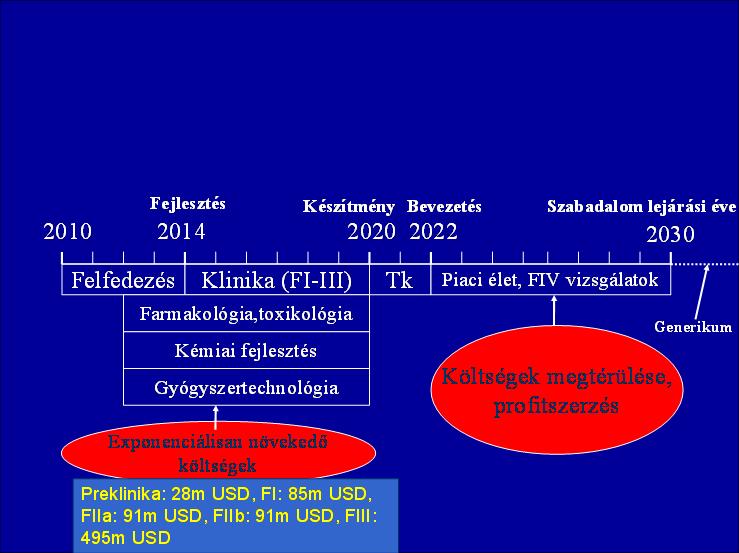
1. ábra: Az originális gyógyszer K+F-folyamata
|
|

Melyek a gyógyszeripari K+F alapvető jellemzői?
|
Generikus K+F esetében ez lényegesen rövidebb lehet (2. ábra), de a bioszimiláris fejlesztés időigénye jelentősen több, mint a hagyományos generikumé.
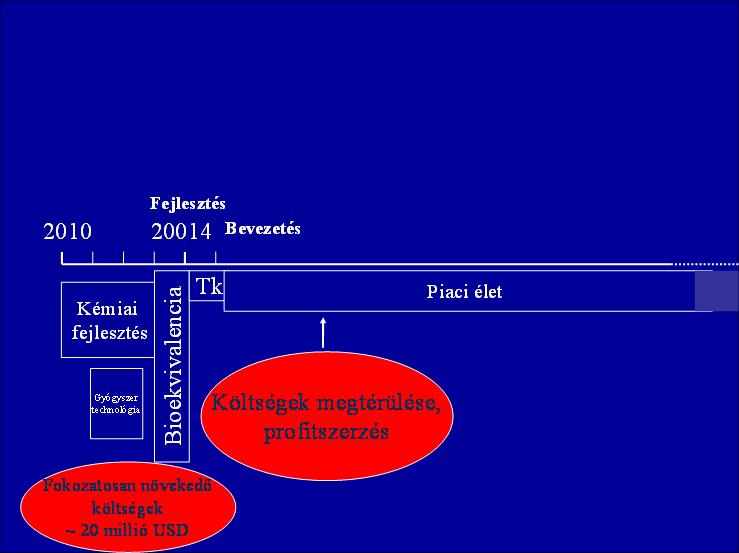
2. ábra: A generikus gyógyszer K+F-folyamata
|
-
B.) Költségesség: Egy eredeti molekula kifejlesztése 800-1.200 (!) M USD ráfordítást igényel. Hagyományos generikum esetében ez lényegesen kisebb összeg, de a bioszimiláris molekulák fejlesztése erősen megközelítheti az originális költségeket tekintettel arra, hogy esetükben nem elegendő egy bioekvivalencia vizsgálat, hanem szükség van bizonyos preklinikai és terápiás vizsgálatok elvégzésére is.
-
C.) Alacsony sikerráta: Általános ipari tapasztalat, hogy a kutatási projektek (figyelem: egy projektben sok molekula van!) sikerrátája 10% alatt van. Másként kifejezve, 10 ezer molekulából 1 kerül forgalomba (3. ábra).
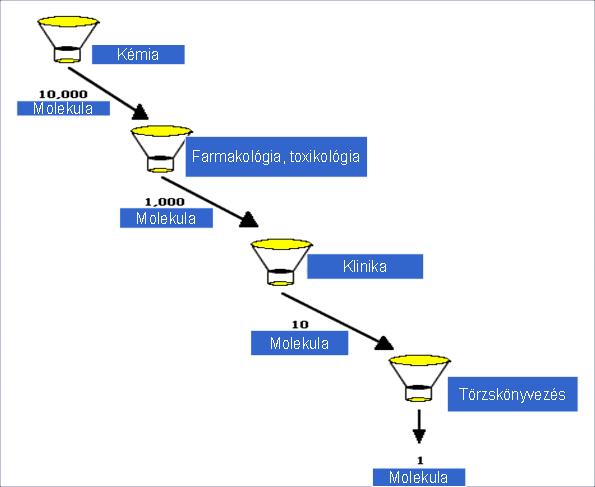
3. ábra: A gyógyszerjelölt molekulák kiesési aránya
|
A kiesés fő okai jelenleg:
-
A.) a biztonságosság nem megfelelő (sok a piacra jutást meghiúsító mellékhatás),
-
B.) a klinikai hatásosság nem igazolható emberen.
Ezek hátterében áll:
-
A.) a preklinikai biztonságossági/toxikológiai vizsgálatok prediktív értéke humán vonatkozásban alacsony,
-
B.) a preklinikai farmakológiai/biológiai vizsgálatok prediktív értéke humán vonatkozásban alacsony vagy zéro.
Mindezek mögött a klinikailag releváns biomarkerek, állatmodellek stb. hiánya áll. Van még egy nagy probléma, és ez a szakemberképzés általános elégtelensége az EU-ban és világszerte, aminek okai sokszor már a középiskolai képzésben kereshetők. Az akadályok leküzdésére az ipar többféle módszert is alkalmaz.
|

Milyen módszereket alkalmaz az ipar az akadályok leküzdésére, illetve milyen európai uniós és magyar kezdeményezések indultak el az elmúlt években?
|
-
A.) Menedzseriális megoldások. Házon belüli szervezeti átalakítások (pl. mátrix rendszer kialakítása) egyrészt, cégek összeolvadása (merger) másrészt a tőkealap megerősítése érdekében. Ez utóbbi lehet „barátságos” és ellenséges. Mindegyikre van példa. Az átalakítások számos emberi problémát és költséget is jelentenek egyúttal.
-
B.) Szakmai megoldások. Új technikák bevezetése (molekuláris biológia, robotkémia, robot biológiai szűrés stb.) házon belülre, illetve hálózati együttműködések (kis- és középvállalatok, biotech vállalkozások, akadémiai kutatóhelyek) révén.
Mindezen módszerek több évtizedes alkalmazása sem okozott azonban igazi áttörést. Új utakat kell keresnünk. Ezen új utak egyike az Európai Unió Innovative Medicines Initiative (IMI) projektje (www.imi.europa.eu). Ez egy egyedülálló PPP-kezdeményezés (Private Public Partnership), amelynek szereplői az európai gyógyszergyártók szövetsége (EFPIA), kis- és középvállatok, akadémiai kutatóhelyek és betegszervezetek. A konzorciális felállás mögött 2007-2013. futamidőre 2 Mrd € pénzügyi forrás áll. Ebből 1 Mrd €-t ad az Unió készpénz formájában és ugyanennyi az EFPIA-résztvevők természetbeni (in kind) hozzájárulása a projektek megvalósításához. A projektek az említett szűk keresztmetszetek feloldását célozzák. Hasonló kezdeményezés indult el hazánkban is az Innovatív Gyógyszerek Kutatására Irányuló Nemzeti Technológia Platform, a Biotechnológiai Nemzeti Technológiai Platform, a Genomikai Nemzeti Technológiai Platform és az Integrált Mikro/Nanotechnológiai Nemzeti Technológia Platform 2010. évi összefogása révén.
Gyógyszeralkalmazási klinikai kutatások
Ezek a klinikai kutatások a már piaci forgalomban lévő gyógyszerekkel kapcsolatosak. Lehetnek:
-
A.) ipari és
-
B.) akadémiai indíttatásúak
|

Melyek a gyógyszeralkalmazási klinikai kutatások fő céljai?
|
Fő céljuk:
-
A.) mélyebb ismeretek szerzése hatás, mellékhatás, interakció, hatásmechanizmus stb. terén igen nagy populációban (megatrial),
-
B.) terápiás eljárások kidolgozása (lásd: kombinációk, terápiás irányelvek kidolgozása).
Az ipari indíttatású, általa szponzorált vizsgálatok esetében mindig felmerül az elkötelezettség gyanúja. Ennek elhárítása, leküzdése érdekében számos intézkedést történt, de a probléma továbbra is fennáll (negatív eredmények visszatartása, vizsgálatok elfogult prezentálása, a vizsgálók személyes érintettsége stb.).
Az akadémiai indíttatású vizsgálatok esetén ezek a rizikótényezők kisebbek ugyan de bizonyos mértékig fennállhatnak.
Alapvető nehézségnek tekinthető, hogy általánosságban az ipar rendelkezik mindazon anyagi háttérrel, humán erőforrással és (adminisztratív) gyakorlattal, ami egy klinikai vizsgálat sikeres és megfelelő időkorlátok közötti végrehajtáshoz szükséges. Az akadémiai indíttatás esetén a források szűkösebbek, noha a szellemi kapacitás vitathatatlan és sok esetben nagyobb, mint az iparban.
|

Mit szabályoz az EU 2001/20/EC direktívája?
|
Jól példázza a feszültségeket az EU 2001/20/EC direktívája (Directive 2001/20/EC of the European Parliament and of the Council), amely előírja, hogy az EU-tagállamokban hogyan kell az emberi használatra szánt gyógyszertermékeket vizsgálni, a GCP-t helyesen implementálni a tagországok jogi, hatósági és adminisztratív szabályozásába. Akadémiai oldalon hatalmas a felháborodás, egyesek ezt a direktívát egyenesen a tudomány szabadsága elleni merényletnek nevezték és nevezik ma is. Kétségtelen, hogy a direktíva nincs tekintettel arra, hogy a klinikai vizsgálat ipari vagy akadémiai indíttatású. Ebből fakadóan az akadémiai szponzor számos nehézséggel néz szembe, de nincs könnyített út. Az első sokkon túlesve, azonban mutatkoznak a megoldás jelei. Ennek egyik formája lehet az European Clinical Research Infrastructures’ Network (www.ecrin.org) (ECRIN) tevékenysége, amelynek hazánk is aktív tagja.
Útravaló (take home) üzenet
-
A.) A klinikai kutatások komplex tevékenységek,
-
B.) magas fokú szervezettséget igényelnek (csapatmunka),
-
C.) a szabadalmi szempontok (főleg ipari kutatások esetén) alapvetőek,
-
D.) költségesek,
-
E.) időigényesek,
-
F.) a siker nem garantált,
-
G.) de mindenkinek van esélye rá.
Irodalom
-
Gachályi, B. – Lakner, G. – Borvendég, J. (szerk) (2002): Klinikai farmakológia a gyakorlatban. Springer, Budapest
-
Dinya, E. (szerk) (2006): Humán gyógyszerfejlesztés. Medicina, Budapest
-
Lakner, G. – Renczes, G. – Antal, J. (szerk) (2009): Klinikai vizsgálatok kézikönyve. SpringMed, Budapest
-
Ajánlott weboldal
-
www.ogyi.hu (Innen számos releváns nemzetközi honlap is elérhető)
|
|