 |
XVIII./2. fejezet: Epigenetikai módosítások
Az epigenetikai módosulásnak több szintje ismert, a DNS szekvencia szintjén a citozinok metil csoport beépülésével 5’-metil-citozinokká alakulnak, mely befolyásolja a DNS átíródási képességét, a hiszton molekulák poszttranszlációs módosítása és megfelelő pozicionálása a DNS molekula kromatin szerkezetének befolyásolásán keresztül szintén a transzkripció szintjén fejti ki epigenetikai szabályozását. Ezzel szemben a kis, nem-kódoló RNS molekulák képesek mind a transzkripció, mind a transzláció szintjén befolyásolni a gén-kifejeződést. Az egyes epigenetikai jelek további molekulákat is képesek vonzani, mellyel tovább befolyásolják, remodellezik a kromatin állományt. A kromatin állománynak két fő funkcionális állapota van: a heterokromatin és az eukromatin, míg az előbbi egy zártabb, transzkripcionálisan gátolt, addig az utóbbi egy lazább, a transzkripciós gépezet számára hozzáférhető állapot (2. ábra).
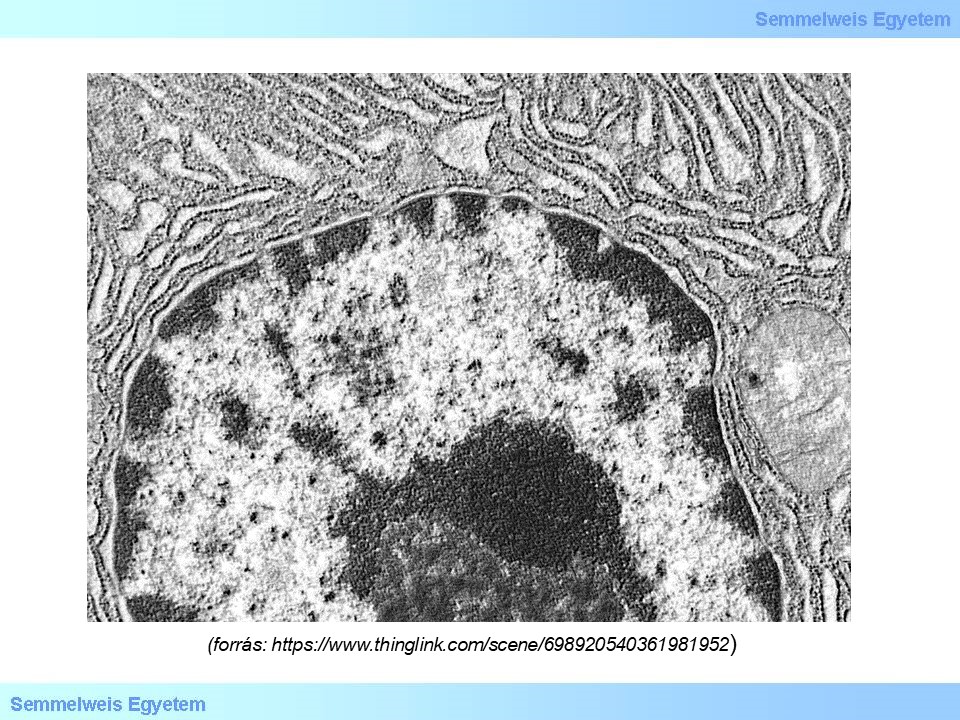
2. ábra: Elektronmikroszkópos kép a sejtmagról, benne a sötétebb részek a heterokromatinra a világosabb részek pedig az eukromatinra utalnak.
|
|
 |
XVIII./2.1. DNS metiláció
A DNS metiláció egy reverzibilis kovalens módosulása, mely kevesebb, mint 5%-át érinti a humán genomnak és a mitotikus sejtosztódás során is megmarad. Maga a metiláció a citozin bázis pirimidin gyűrűjének ötös szénatomján történik (5-metil-citozin vagy 5mC).
Ezt a folyamatot az 1970-es évek közepén Holliday és Pugh írta le először, és ma már az 5mC-t a DNS molekula ötödik bázisának tekintik. A metil csoport S-adenozil-metioninról (SAM, 3. ábra) történő átkapcsolását a citozin molekulákra a DNS metil-transzferázok (DNMT) katalizálják (4. ábra). Jelenleg 5 különböző DNMT enzimet ismerünk (DNMT1, DNMT2, DNMT3A, DNMT3B és DNMT3L) melyek két különböző folyamat szabályozásában játszanak szerepet.

3. ábra: S-adenozil metionin (SAM) szerkezete
|

4. ábra: A citozin átalakulása 5-metilcitozinná. DNMT – DNS metil transzferáz, SAM – S-adenozil metionin
|
Az egyik folyamat a metilációs mintázat replikáció alatti megtartásáért (DNMT1), míg a másik a de novo szintéziséért felelős (DNMT3A és DNMT3B). A DNMT1 esszenciális a megfelelő embrionális fejlődés, az imprinting és az X-inaktiváció során is. A DNMT fehérjecsalád, más enzimekkel együtt, a gének csendesítését és a represszív kromatin állomány fenntartását tudja elősegíteni. A metilált DNS további olyan fehérjéket vonz magához, melyek rendelkeznek metil-kötő doménnel (MBD) és képesek megakadályozni a transzkripciós faktorok bekötődését, így fokozva a géncsendesítést. Az első leírt metil-kötő fehérje a MeCP2 (methyl-CpG-binding protein 2) volt.
Ezzel szemben a DNS demetiláció során a metil-citozinok aktív vagy passzív módon alakulnak vissza citozin molekulává. Ez a folyamat biztosítja az epigenetikai kód reverzibilitását. A passzív folyamat során a DNMT1 fenntartó metil transzferáz gátlása valósul meg a DNS replikációja során. Ezen kívül a demetilációt az is elősegítheti, ha nem áll rendelkezésre a sejtben megfelelő mennyiségben metil-donorként funkcionáló SAM molekula vagy DNMT enzim. A replikáció független aktív mechanizmus során a TET (ten-eleven translocation) enzim család játszik kulcsfontosságú szerepet. Jelenleg három TET enzim ismert, a TET1, TET2 és TET3, melyek képesek katalizálni az 5mC hidroxilációját, melyet egy aktiváció-indukálta citidin deamináció követ. A demetiláció következményeként az adott területről fokozódik a gén kifejeződése.
|
 |
A metiláció leggyakrabban olyan citozin molekulákon történik, melyeket egy guanin követ (CpG), ahol sok CpG pozíció követi egymást, ezt a genomi régiót CpG szigetnek nevezzük (5. ábra). A CpG szigetek a metiláció legáltalánosabb helyei a genomban, általában a promóter régiókban és a gének első exonjaiban dúsulnak fel.
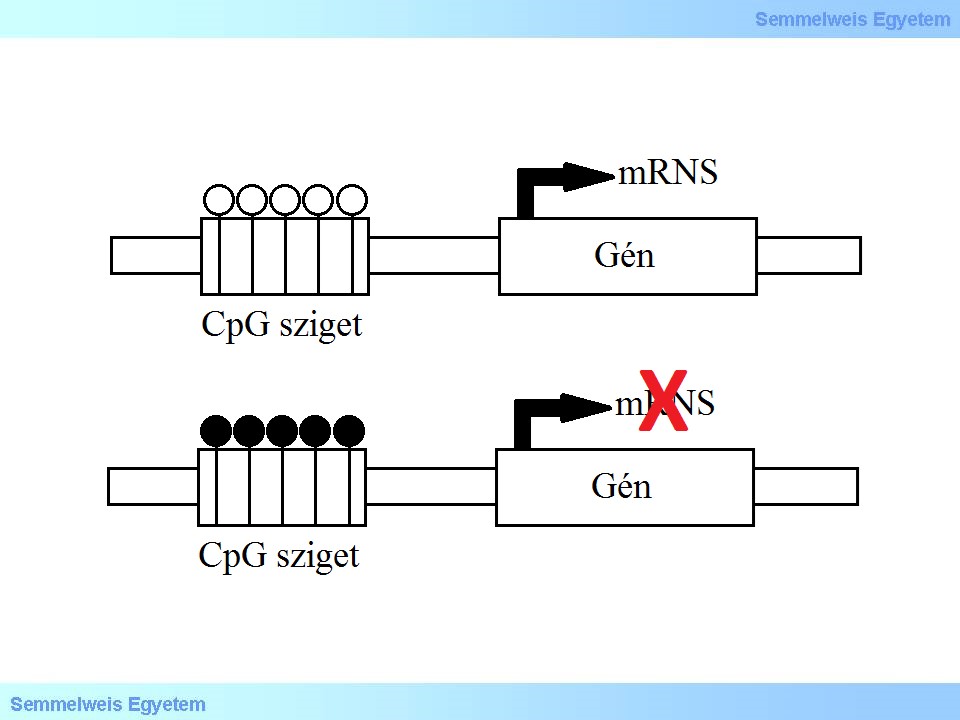
5. ábra: CpG sziget elhelyezkedése és funkciói. Nem metilált CpG sziget a gének promóter régióiban elősegíti a transzkripciót. Metilált citozinok a gének promóter régióiban gátolják a génexpressziót. Fehér kör: nem-metilált citozin, fekete kör: metilált citozin.
|
A CpG szigeteken megnyilvánuló metilációs mintázat örökölhető szövet és faj specifikus tulajdonság is lehet. Ez nem meglepő, mivel a DNS metiláció speciális epigenetikai memóriaként funkcionál az egyes sejttípusokban, mely stabilitásának köszönhetően a sejtciklusok alatt is megmarad, így szabályozva a gének megfelelő expresszióját az utódsejtekben is. Így már a korai életszakaszban történő tápanyagbevitel képes befolyásolni a felnőttkorban megnyilvánuló DNS metilációs mintázatot és génexpressziós szintet. Ismert például, hogy a folsav és B12 vitamin a SAM ciklus szabályozásán keresztül fontos szerepet játszik a metiláció megfelelő végrehajtásában.
Általában az emberi DNS akár 70-80% metilált a CpG szigeteken, és korreláció mutatható ki a metiláció és az expresszió szintje között cisz és transz helyzetben. Valamint a DNS metiláció képes befolyásolni a mutációk kialakulását, a hibátlan és tartós DNS meglétét, a gén expressziót és a kromatin módosulásokat.
A DNS metilációs és demetilációs folyamatai már önmagukban képesek a génexpresszió elkerülhetetlen változását okozni, ezáltal a sejt megfelelő működését szabályozni, biztosítva a sejt adaptív reakcióját különböző környezeti hatásokra. Ezenkívül a metilációs mintázat a hiszton kód (lásd hiszton módosítás) megnyilvánulását is képes szabályozni, a hipermetiláció például hiszton deacetilázokat (HDAC) is képes toborozni, ezáltal megteremtve az egyes epigenetikai módosítások közti párbeszéd első fokát.
|
|