|
3.: Az arteriosclerosis (érkeményedés, érelmeszesedés), mint a szívizominfarctusra hajlamosító legfontosabb betegség
1.: Fogalom-meghatározások
|
 |
Az arteriosclerosis (az érfalkeményedéssel járó elváltozások gyűjtőfogalma) az erek falának degeneratív elváltozása. Jellegzetes megjelenési formája a plakk.
A plakk olyan, jellemzően verőerekben előforduló, degeneratív természetű érszűkületi falmegvastagodás, amelyben az ér falának egy körülhatárolható területén új, elsősorban kötőszövetirost-, zsír- és/vagy mésztartalmú összetevők jelennek meg, amik súlyossági fokozattól függően
-
- átalakítják az érfal szerkezetét,
-
- megváltoztatják mechanikai tulajdonságait, és – tömegesedésük bizonyos fokán túl –
-
- szűkítik az ér keresztmetszetét.
-
1. Az érfal szerkezetének átalakítása azt jelenti, hogy a plakkot képző anyag-, illetve szövettöbblet kezdetben az intimát megvastagítás útján deformálja, később beterjed a médiába is, és ezen rétegeket megszüntetve az érfal eredeti szerkezetét megváltoztatja.
-
2. A mechanikai tulajdonságok megváltoztatása azt jelenti, hogy az ütőérfal a plakk helyén elveszti eredeti rugalmasságát: az esetek egy részében – fibrosus és/vagy meszes plakkok esetén – merevebb, keményebb lesz, az esetek más részében pedig – nagy, atheromás plakkok esetén – inkább felpuhul, később akár ki is boltosodik, s mindezek miatt az ér az eredeti szélkazán-funkciójának mind kevésbé tud megfelelni, illetve a vér pulzáló terhelésének ellenállni.
-
3. (A plakk-növekedés és érszűkítés azt jelenti, hogy a falban keletkező anyag- és szövettöbblet valódi térfoglalásként jelentkezik, és az ér űrtere felé növekedve az ér hasznos áteresztőképességét mindinkább korlátozza.
Az arteriosclerosison belül elkülönítenek ún. atherosclerosist, mint az elasticus és középnagy muscularis ütőerek betegségét, illetve ún. arteriolosclerosist, mint a kis muscularis ütőerek és arteriolák betegségét. A Mönckeberg-féle mediasclerosis az érkeményedés sajátos és ritka formája. Mindezen érelváltozások kitüntetett gyakorisággal és összetettségben fordulnak elő bizonyos anyagcsere betegségekben, mindenekelőtt diabetes mellitusban. A sajátos szövődményformák között említendők az érfal helyi kiboltosulásai (ún. aneurysmák vagy érgurdélyok), illetve rétegeinek szétválása (érfalszétválás, dissectio).
2.: Epidemiologiai jelentőség
|
 |
Az érelmeszesedés halálokként a fejlett országokban az esetek 50%-ában fordul elő (ún. civilizációs betegség). A klasszikus elképzelésekkel szemben – miszerint az arteriosclerosis az idős kor betegsége lenne – ilyen érelváltozások már fiatalkorban kezdenek kialakulni. Az erről szóló első beszámolók az 1950-es években az amerikai irodalomban jelentek meg a koreai háború idején harc közben elesett fiatal katonák kórboncolási leleteinek alapján.
3.: Zsíranyagcsere
Az arteriosclerosis kialakulásában a lipid metabolismus alapvető szerepet játszik. A szervezet zsírháztartásában szereplő fő lipidek jellemzői az 1. táblázatban találhatók.
|

Tekintse meg a táblázatot, és elemezze a látottakat!
|
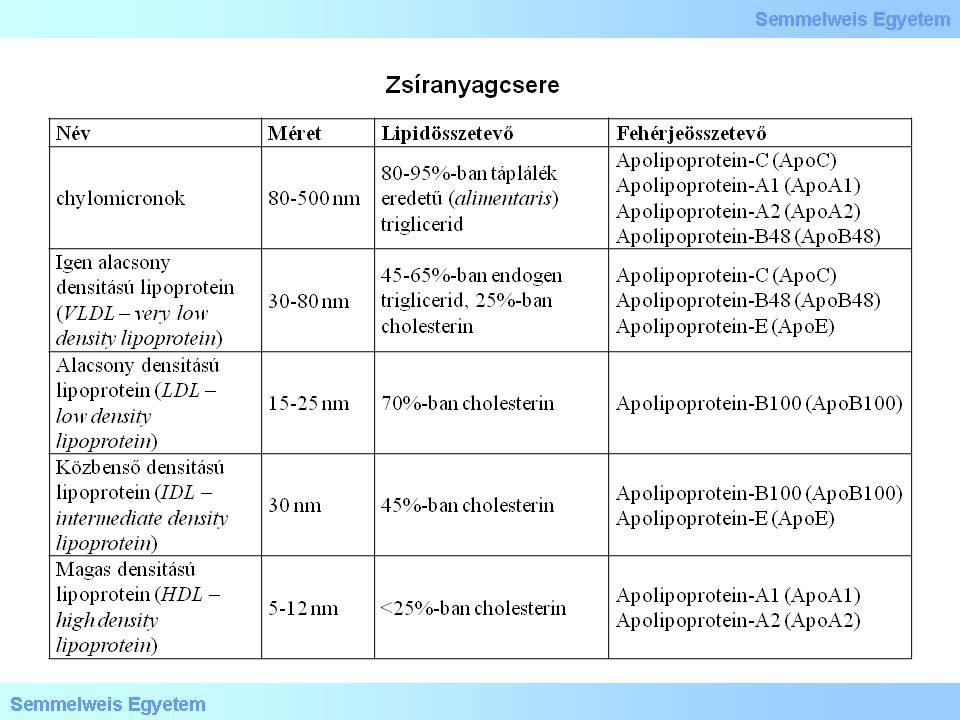
1. táblázat: Zsíranyagcsere
|
E lipidek transzportjának ún. exogen útja a belektől a májig vezető, alapvetően centripetális irányú út; az így szállított zsírok chylomicronok. A lipidtranszport ún. endogen útjának centrifugális irányú része a zsírokat a májból VLDL formájában az érhálózatba, majd a perifériás (extrahepaticus) szövetekhez szállítja, miközben a lipoprotein-lipáz segítségével IDL-lé, illetve LDL-lé alakulnak. A centripetális irányú transzport során a perifériás szövetekből kerülnek a zsírok a májba HDL, IDL, illetve LDL formában.
4.: A scleroticus érelváltozások sejtes elemei
|
 |
Az érkeményedéses elváltozásokban részt vevő legfontosabb sejtelemek az endothelsejtek, a monocyták/macrophagok és a simaizomsejtek.
4.1.: Endothelsejtek
Az ép endothel legfontosabb funkciója, hogy az erek számára nonadherens, nonthromboticus belfelszínt biztosításon. Szabályozza ezen kívül az érfal permeabilitását, fibrinolyticus és alvadási mikrokörnyezeti viszonyokat, a leukocyták és a thrombocyták kitapadását (ún. homing), a zsíranyagok oxydatioját. Jellemző továbbá, hogy ún. chemoattractansokat és extracellularis mátrixkomponenseket termel, az érfal simaizomsejtjeire proliferatios és migrációs hatást fejt ki, anyagcsere (pl. LDL-oxydatio) tevékenységet végez, vasoactiv termékei (NO, PGI2, endothelin, angiotensin II, TXA2) útján fenntartja az erek rugalmasságát és tónusát, illetve pl. a basalmembrán termelésével az érfal szerkezetét, részt vesz gyulladásos és immunológiai válaszreakciókban.
4.2.: Monocyták/macrophagok
|
 |
Az atherogenesis központi fontosságú sejteleme. Oxidáció és extracellularis zsíranyagok felvétele, habsejtek képzése útján részt vesznek a zsíranyagcserében. Rendkívül nagyszámú cytokint termelnek, mint amilyenek a növekedési faktorok (GM-CSF, M-CSF, HB-EGF, IGF-I, VEGF, bFGF, TGFα, PDGF, IL-2), növekedés-gátlók (IL-1, TNFα, TGFß), chemoattractansok (MCP-1, oxLDL). Lényeges védekező-rendszeri szerepük az antigének prezentációja T-sejtek számára, illetve hogy ‘scavanger’ (utcaseprő) hatásukkal káros anyagok eltávolítására, semlegesítésére képesek.
4.3.: Simaizomsejtek
A simaizomsejteknek két eltérő phenotípusa van: az
-
a) contractilis és a
-
b) syntheticus.
A contractilis phenotípus az általánosan ismert sejtváltozat, amely gazdag lévén myofilamentumokban, összehúzódásra képes. Zsírfelvétele és -leadása kiegyensúlyozott, lipid accumulatio nincs, ebből a sejtfajtából nem keletkezik habsejt. A syntheticus phenotípus sejtjei ellenben durva felszínű endoplasmás reticulumban (RER) gazdagok, cytokin (PDGF, bFGF, TGFß) stimulusra extracellularis matrixkomponenseket termelnek, és LDL- illetve ‘utcaseprő’-receptorokat expresszálnak, mely utóbbiak a zsírleadás mértékét meghaladó zsírfelvételre, következményes lipid accumulatiora, ezzel együtt pedig habsejtekké való átalakulásra teszik képessé e sejtfajtát. A simaizomsejtek képesek a mediából az intimába vándorolni.
5.: Atherogeneticus elméletek
|
 |
Az érkeményedés keletkezésére vonatkozóan jobbára elméletekkel rendelkezünk. Ennek fő oka, hogy kísérletesen nehezen modellezhető kórfejlődésről van szó, mert a betegség multifaktoriális és hosszú éveken, évtizedeken át tart, amíg kialakul. A mai elképzeléseinket legátfogóbban az ún. ‘sérülésre adott válasz’ (‘response to injury’) elmélete magyarázza, olyannyira, hogy a többi elmélet ennek egyes elemeit hangsúlyozva inkább csupán részválaszokat ad, illetve e részelméletek megállapításai jól beépíthetők a sérülésre adott válasz elméletébe. A ’lipid elmélet’ a hangsúlyt az érfal zsíranyagcsere-anomáliáira helyezi. A ’thrombogén elmélet’ a legrégebbiek egyike, míg a ’gyulladásos illetve fertőzéses, autoimmun elmélet’ a többféle eredetű lobos reakciókra helyezi a hangsúlyt.
5.1.: A ‘sérülésre adott válasz’ (‘response to injury’) elmélete
Az elmélet lényege, hogy az atherogenesis az érfal bármilyen jellegű károsító behatásra adott stereotyp ellenreakciója. Központi folyamata az endothel fokális aktivációja (stimulatioja) és reaktivitásának, anyagcseréjének átállítódása, mint az atherogenesis és a plakk-képződés kezdeti lépése.
5.1.1.: Az érfalat károsító hatások, jellegük és hátterük
|
 |
A káros behatások fajtái igen sokfélék lehetnek, így például – többek között – sejtbiológiai, geometriai, microanatomiai ( ún.‘progression-prone’ vs. ‘progression-resistant’ helyek), mechanikai-haemodynamikai, vérkémiai, mikrokörnyezeti jellegűek, illetve e hatásfajták megjelenhetnek kombináltan is.
|
 |
Újabban felismert, vérkémiai-sejtbiológiai jellegű, ubiquitaer endothelkárosodási mechanizmus a hem-mediálta cytotoxicitás. Hatására az endothelkárosodás egyik fajtája, helyi oxydativ stressz lép fel. A vörösvértestekből kiszivárgó haemoglobin a plasmában oxydálódik, és ferri- vagy methaemoglobin képződik, miközben a hem felszabadul fehérjeburkából. A szabad hem, illetve hem-Fe az endothel számára toxicus – mindkettő képes ugyanis szabadgyök-reakciókat katalizálni és így pl. aktivált polymorphonuclearis granulocyták (PMN) okozta sejtkárosodást potencírozni (az oxidánsok okozta cytotoxicitás sejt-mediált cytotoxicitással való súlyosbítása). Különösen az így kiszabadult hem hatótávolságában levő endothelsejtek vannak nagy veszélynek kitéve.
A károsodás úgy jön létre, hogy az igen hydrophob hem minden sejtmembránon akadálytalanul átjut, azaz könnyen és spontán penetrál az endothelsejtekbe. A felszabaduló hem-Fe sejtmembrán-összetevők és áthaladó LDL-molekulák oxydátiójának igen aktív katalizátora. Az így keletkező oxLDL az endothelsejtek direkt cytotoxictását és oxydativ stresszét idézi elő. Hogy a mondott folyamatok öngerjesztő módon mégsem szabadulhatnak el, az védekező fehérjéknek köszönhető. Ezek egyike a
|
 |
-
a) haemopexin, amely extrém magas koncentrációjú és kifejezett hem-kötő képességű serumprotein. Ugyanilyen hatásúak a
-
b) haptoglobin és az albumin, mint szintén hem-kötő képességű plasmaproteinek. Sajátos intracellularis fehérje-együtthatást képvisel
-
c a hem-oxygenáz-1 (HO-1) és a ferritin: a HO-1 feltöri a hem protoporphyrin gyűrűjét és felszabadítja annak aktív vastartalmát, az utóbbit az antioxidáns vastároló ferritin köti le.
A folyamatok fontos meghatározója mindama szervezeti-constitutionalis háttér, amelyben azok végbemennek. Ide értendő mindenekelőtt a gazdaszervezet genetikai constitutioja, valamint a vérösszetevők vegyi összetétele. Utóbbin elsősorban a vér olyan tulajdonságai, mint pl. pH-értéke, vagy atherogen zsírtelítettsége értendő. A gazdaszervezet genetikai constitutiojának szerepe azon alapszik, hogy minden bonyolult, lépések és együtthatások szövedékéből kifejlődő kórfolyamat – mint amilyen az atherogenesis is – dinamikáját befolyásolhatja az egyes lépésekben szereplő összetevők (itt: faktorok, transzportmolekulák, enzimek, stb.) működési hatékonysága, amely hatékonyságok változása az adott összetevő által ellátott részfolyamatot gyorsítva vagy lassítva megváltoztathatja az egész folyamatot is.
|
 |
Mivel egy részfolyamat működési hatékonyságát számos tényező – a benne résztvevő fehérjék tekintetében pl. a genetikai kód meghatározta aminosav-szekvencia, a szekvencia és a mikromiliő hatására létrejövő térszerkezet, stb. – befolyásolhatja, és mivel a teljes kórfolyamat nagyszámú részfolyamatból tevődik össze, így a teljes gazdaszervezet szintjén szinte végtelen számú hatás eredőjeként jön létre maga a betegség, amely épp emiatt az egyes molekulák működésén keresztül a kialakulás finomhangolásának számtalan lehetőségét hordozza magában.
Ezért lehetséges, hogy jól definiálható tünetegyüttesek (syndromák) nélkül is számos emberben viszonylag korán viszonylag súlyos arteriosclerosis alakul ki (hétköznapi kifejezéssel élve: ’érbetegségre hajlamos’), míg mások élemedett korban is fiatalos érviszonyokkal rendelkeznek, avagy hogy az atherogeneticus hajlam bizonyos – szociális-, táplálkozási-, életmód-, stb. környezetben – megnyilvánul, míg egy másikban nem (ld. idegen országokba bevándorlók epidemiologiai adatainak változását). Egy jól működő gazdaszervezeti rendszer ugyanis működési egyensúlyát még károsító tényezők mellett is képes fenntartani, míg kevésbé stabil biológiai helyzetben a működési egyensúly már enyhe kockázati helyzetben is sérül, és fenntartására külön figyelni kell (az előző esetben az ember ’ehet, amit akar’, a második esetben pl. koleszterin-diétára szorul).
5.1.2.: A plakk-képződés haemodinamikai tényezői
Érelágazódásoknál (ún. flow dividers) az eredeti lamináris áramlás megtörik, és a véráram kettéoszlását közvetlenül követő érszakaszban örvénylés keletkezik. Ez csökkent nyíróerőkkel, de főként a vérösszetevők forgó-keringő mozgása révén azoknak az adott érfalszakasz feletti meglassult előrehaladásával jár, amivel az atherogen vérösszetevők megnyúlt behatási időhöz jutnak. Egyszerű kórbonctani megfigyelés az, hogy az atherosclerosis érelágazódások vidékén jellemzően súlyosabb.
5.1.3.: Az elmélet lényege
|
 |
A károsító hatás kiváltotta endothel stimulatio e sejtek zsíranyagcseréjében változást idéz elő (oxLDL-produkció!), illetve biologiailag aktív molekulák termelését (chemoattractansok, mitogenek, növekedés-regulátorok, NO, adhesiós molekulák, thrombogen faktorok) okozza. Minderre válaszul az aktivált endothelsejtek felületére keringő sejtelemek – leukocyták, thrombocyták, monocyták, T-lymphocyták – tapadnak ki (homing), és az intercellularis réseken át az intimális térbe szüremkednek, ott felszaporodnak, majd maguk is migratiós, osztódási és növekedési faktorokat termelnek, biológiailag aktív sejtek újabb és újabb hullámát vonzva a helyszínre.
Az endothel stimuláció további következménye, hogy e réteg áteresztőképessége (permeabilitás) nő, fokozódik a zsíranyagok és sejtelemek intimális beszüremlése (insudatio). Az intima sejtdússágát az ellenoldal felől a media eredetű simaizomsejtek membrana elastica interná-n keresztüli bevándorlása is növeli, illetve a microkörnyezet citokin hatásaira válaszul maguk az eredendően intimális simaizomsejtek is proliferációba kezdenek. A megnövekedett simaizomsejt-tartalom azután meghatározó a plakk-képződés szempontjából, mert contractilis phenotípusból syntheticusra történő váltásuk extracellularis matrixkomponensek termelését (leginkább collagen) eredményezi.
Egyidejűleg az idesereglett monocyták átalakulnak macrophagokká, és a syntheticus simaizomsejtek részvételével az extracellularis lipidek bekebelezésébe fognak, minek hatására mindkét sejtfajtából tömeges habsejtképződés indul meg. A habsejtek részben bele is pusztulnak a mértéktelen zsírfelvételbe, és intracellularis lipidtartalmuk extracellularis zsírtócsákká olvad össze, illetve pusztulásukkor bioaktív citokinjeik a környezetbe jutva újabb sejtelemeket vonzanak. A folyamat így hólabdaszerűen öngerjesztővé válik, és kialakul az atheromás plakk.
5.2.: Lipid elmélet
Központi kóroki jelenségnek tekinti a zsíranyagok lerakódását (insudatio) az érfal rétegeibe. Ennek jelentőségét számos epidemiologiai, kliniko-patológiai megfigyelés támogatja, úm.:
|
 |
-
a) összefüggés a testsúly és az arteriosclerosis között;
-
b) a plakk-képződésnek magas seLDL- és seVLDL-, illetve alacsony seHDL-értékek melletti fokozott kockázata;
-
c) atherogén diéta hatása állatkísérletekben;
-
d) öröklött zsíranyagcsere-zavarok hatása az érrendszerre (receptor megkevesbedés, illetve -hiány, génkárosodások, familiáris hyperlipidaemia).
Az elmélet lényege, hogy zsíranyagok szüremlenek az intimába, ahol az ezekkel együtt megjelenő monocyták/macrophagok megkezdik a zsírok bekebelezését, de specifikus LDL-receptoraik idővel telítődvén, a zsírfelvételbe bekapcsolódnak aspecifikus, ún. ‘scavanger’ (utcaseprő) receptoraik is, amelyek szinte gátlástalan zsírfelvételt tesznek lehetővé. Mivel a felvétel üteme így meghaladja a sejt anyagfeldolgozó képességét, a felesleget zsírcseppek formájában tárolja, és belőle a habsejt képződik. A kóros zsíranyagcsere terméke az oxLDL, amely oxydativ stressz útján részt vesz az endothel stimulatiojában. Ez utóbbi viszont adhesiós molekulákat termel, és újabb monocytákat vonz a helyszínre.
5.3.: Thrombogén elmélet
Központi kóroki jelenségnek tekinti érfali (nem feltétlenül occlusiv) thrombosis kialakulását, amely további keringő sejtes elemek odagyülemlése útján súlyosbodik, majd szervül, így hozva létre a kifejlődött plakkot. Mai felfogásunk szerint a thrombosis inkább szövődménye, semmint kezdő lépése az atherogenesisnek.
5.4.: Gyulladásos-fertőzéses-autoimmun elmélet
|
 |
Az esetek egy nem elhanyagolható részében konvencionális kockázati tényezőkkel nem magyarázható meg a betegben kialakuló érkeményedés. Újabban ezért intenzív kutatás tárgya lett nem-konvencionális vagy alternatív rizikófaktorok keresése, amely az erek falának megbetegedett szakaszaiban található több-kevesebb idült lobos infiltrációra irányította a figyelmet. Ezek kóroktanában legelsősorban lappangó fertőzéses eredetre következtettek, illetve felmerült steril gyulladás lehetősége is immunreakció, illetve autoimmunitás keretében. E feltételezéseket tovább erősítette az az általános kórszövettani megfigyelés, hogy az arterioscleroticus elváltozások vidékén szinte mindig van némi kísérő lymphocytás jelenlét.
Az említett kutatások eredményesek voltak annyiban, hogy a beteg érszakaszokon változó gyakorisággal valóban bizonyítható egyes kórokozók jelenléte. Az a lényeges kérdés azonban még nem tisztázódott megnyugtatóan, hogy e kórokozók vajon ténylegesen tevékeny okozói, illetve súlyosbítói a kórfolyamatnak, avagy csupán ’ártatlan szemlélői’ annak (az ún. innocent bystander-hypothesis). Mindenesetre a kórokozók eradikálására, és ezzel a scleroticus érelváltozások gyógyítására bevezetett fertőzés-ellenes (antibiotikus) kezeléssorozatok nem hoztak egyértelmű sikert, talán épp az atherogenesis multifaktorialitása miatt.
|
 |
A kórokozók közül a leginkább vizsgált ágens a Chlamydia pneumoniae (felfedezés éve: 1989), amely magasan specializált, Gram-negatív baktérium, obligát intracelluláris energia-parazita, nem lévén önálló energiatermelő rendszere. Intracellularis helyzete elrejti az immunrendszer elől, és hasonlóan a Chlamydia-genus legismertebb tagjához, a C. trachomatis-hoz (felfedezés éve: 1907), jellemzően lappangó, idülten elhúzódó, heveny fellángolások nélküli, kötőszövet-szaporulatot, hegesedést indukáló (ld.: fibrosus plakk) gyulladás okozójává válhat. Az érrendszeren kívüli jellemző pathogen előfordulási helye a légutak.
További, vizsgálatok tárgyává vált kórokozók a Helicobacter pylori (kóroki szerepe az érelmeszesedésben soha nem vált komolyan valószínűvé), a CMV, a Herpes simplex vírus, a Mycoplasma pneumoniae, a hepatitis-A vírus. Ezeknek is közös jellemzője, hogy majdnem mindegyik intracellularis pathogen ágens. Hatásukra az erek eredendően antiinflammatoricus, antikoaguláns, antiatherogen mikromiliője proinflammatoricus (humoralis és sejtes reakciók kiváltása útján), prokoaguláns és proatherogen irányba tolódik el.
A kutatások során felvetődött az autoimmunitas lehetősége is. Ún. anti-cholesterin antitestek (ACHA) felfedezése, és a kontroll populációhoz képest érkeményedéses betegekben magasabb serum-értékek leírása arra utalhat, hogy a scleroticus plakkok cholesterin-tartalmú atheromás magja a hosszan fennálló érbetegség során autoimmun állapot célpontjává válhat, s ez akár a progresszió súlyosbodásához vezethet.
6.: Kockázati tényezők
Az eddigiek alapján az érkeményedés kockázati tényezői tehát feloszthatók
-
- hagyományos (konvencionális) és
-
- „új”, nem-konvencionális (alternatív) csoportra.
A fontosabb hagyományos (konvencionális) kockázati tényezők a következők:
|
 |
-
- hyperlipidaemia, hypercholesterinaemia
-
- cukorbetegség (diabetes mellitus)
-
- dohányzás
-
- elhízás (obesitas)
-
- magasvérnyomás-betegség (morbus hypertonicus)
-
- férfi nem, idős kor
-
- hyperhomocysteinaemia
-
- örökletes, genetikai tényezők.
Az érkeményedés „új”, nem-konvencionális (alternatív) kockázati tényezői az érfal gyulladásos válaszán keresztül hatnak:
-
- kórokozók okozta érfertőzés
-
- immunreakció, autoimmunitás.
7.: Az érkeményedés morphologiája
7.1.: Anatómiai előfordulási helyek
Súlyos arteriosclerosis anatómiai előfordulási helyei csökkenő gyakorisági sorrendben
-
1) az aorta abdominalis infrarenalis szakasza/aa. iliacae,
-
2) a koszorúerek proximalis szakaszai,
-
3) a mellkasi aorta/a. femoralis/a. poplitea,
-
4) a. carotis interna,
-
5) a koponyaűri erek: a. vertebralis; a. basilaris; a. cerebri media.
7.2.: Az érkeményedés megjelenési formái (AHA-beosztás)
|
 |
Az AHA (American Heart Association) beosztása korai és késői csoportra osztja az arterioscleroticus elváltozásokat, illetve a két csoport között egyetlen átmeneti plakkfajtát határoz meg, a praeatheromát. A korai érléziókra jellemző, hogy az élet első két-három évtizedében alakulnak ki, az érfal reverzibilis elváltozásai, amelyek klinikai tüneteket nem okoznak. A késői léziók ellenben jellemzően az élet későbbi évtizedeire fejlődnek ki, már tünetekkel járnak és az érfal visszafordíthatatlan elváltozását jelentik.
7.2.1.: Korai arterioscleroticus elváltozás – AHA I
Leginkább submikroszkópos elváltozások jellemzik, a jelenségek fénymikroszkóppal akár nem is láthatók. Intracellularis lipidhalmozódás (lipidcseppek, lipid-droplets) jelenik meg egy-egy elszórt sejtben, e sejtek azonban még nem állnak össze sejtcsoportokká, önálló sejtgyülemmé. Akár már kisgyermekkorban is megjelenhet a későbbi, ún. progression-prone érszakaszokon (pl. érelágazódásoknál), ott ahol az élet későbbi szakaszaiban ún. késői laesiók, szövődményes (komplikált) plakkok alakulnak ki.
7.2.2.: Korai arterioscleroticus elváltozás – AHA II
Még mindig intracellularis lipidhalmozódás jellemzi, a sejtek azonban már gyülemekké állnak össze (histiocyta-gyülemek). Ez már makroszkóposan is megjelenő forma, az ún. zsíros csík (fatty streak) (1. makrokép)
|

Tekintse meg a képet!
|
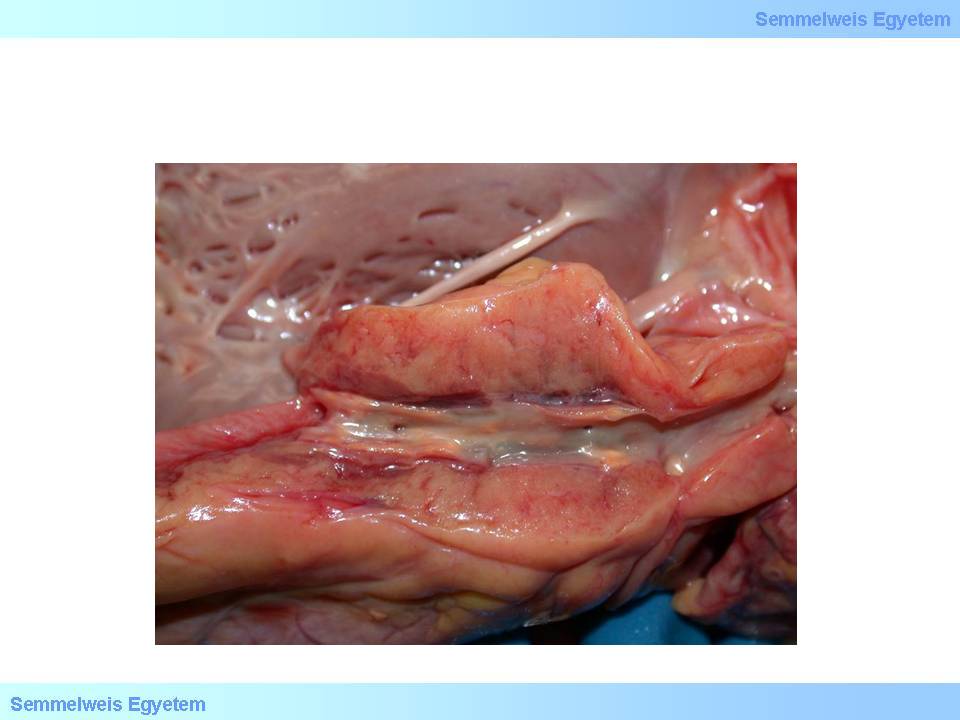
1. makrokép: Zsíros csík, mint korai, enyhe arterioscleroticus elváltozás koszorúéren. Ez a plakkforma nem okoz szignifikáns stenosist. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Glasz Tibor gyűjtése)
|
7.2.3.: Köztes (intermediaer) arterioscleroticus elváltozás – AHA III
Ennek a közbenső csoportnak csak egy tagja van, az ún. praeatheroma. Intra- és extracellularis lipid jelenlét egyaránt jellemzi: ún. lipid tócsák (lipid-pools) jelennek meg. Alaktanilag (intra- és extracellularis zsírfelhalmozás együttes jelenléte) és vegytanilag (zsírsavösszetételében) is köztes helyzetű a korai és késői érelváltozások között.
7.2.4.: Késői arterioscleroticus elváltozás – AHA IV
Ez az ún. atheroma (athera /gr./ – kása), a késői plakk instabil irányban való fejlődési útja. Összetevői: az atheromás zsírmag (ún. lipid core), gyakran kicsapódott, kaszakő alakú cholesterinkristályokkal, valamint a zsírmagot az érlumen felé fedő rostos sapka (ún. fibrous cap), amit az ér endothelbélése borít. Az összetevők aránya szabja meg a plakk stabilitását (ld. ott). A rostos sapka kötőszövetében mész rakódhat le. A mélyebbre kiterjedő atheromás zsírmag akár a media teljes keresztmetszetét is átfoghatja, és ezzel jelentősen gyengíti az érfal mechanikai tulajdonságait, amely a vér állandó belső nyomása alatt fokozatosan kiboltosul, és zsák- vagy orsószerű tágulat, ún. aneurysma (érgurdély) keletkezik.
7.2.5.: Késői arterioscleroticus elváltozás – AHA V
, más nevén ún. fibroatheroma (fibrosus plakk), a késői plakk stabil irányban való fejlődési útja. Az atheromához képest lényegesen kisebb (elenyésző mennyiségű) atheromás zsírmag és vaskos, a plakk döntő többségét kitevő rostos sapka jellemzi. A zsírmag akár teljesen hiányozhat is, ilyenkor a plakk csupán heges kötőszövetből áll. Mész lerakódása a plakk anyagában (2. makrokép) bradytrop viszonyokat jelez.
|

Tekintse meg a képet!
|
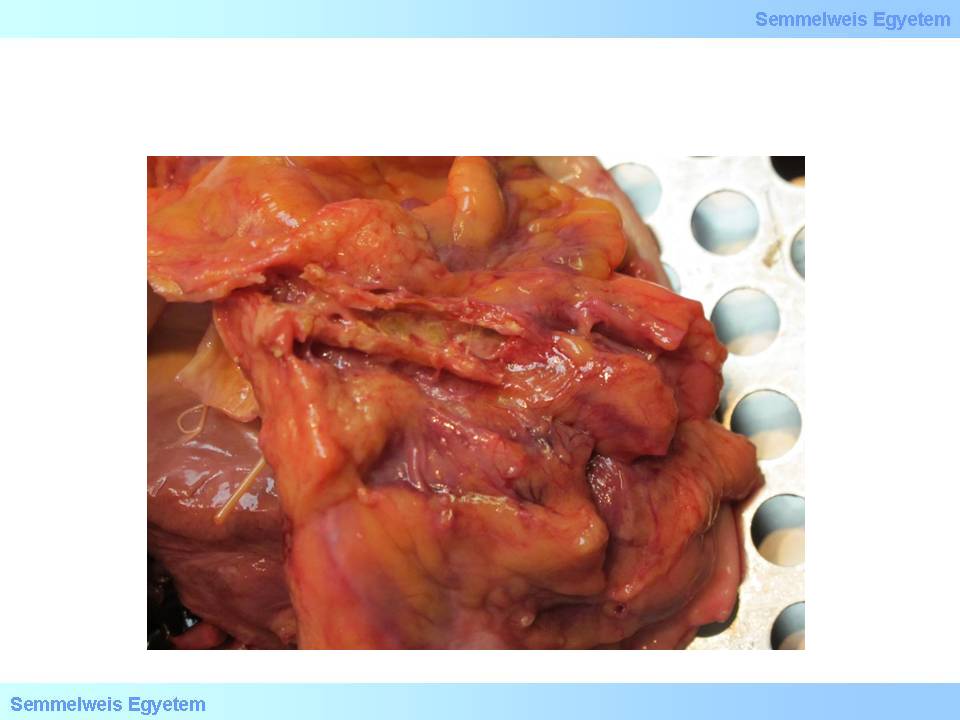
2. makrokép: Meszes plakkok koszorúérben. Mész a plakkfejlődés minden stádiumában megjelenhet a szövetekben, mint a degeneráció jele. (A Semmelweis Egyetem II.sz. Pathologiai Intézetének képarchivumából – Kovács Attila és Kenessey István gyűjtése)
|
7.2.6.: Késői arterioscleroticus elváltozás – AHA VI
Ez az ún. szövődményes vagy komplikált plakk, amely jellemzően az instabil plakkból fejlődik. A szövődménynek két fő formája van: a plakk-bevérzés és a plakk-thrombosis.
-
1. A plakk bevérzésekor a rostos sapka körülírt helyen megreped, és utat nyit a véráramnak a plakk belsejébe, a képlékeny atheromás zsírmagba. A zsírmagba sugárszerűen (jet-jelenség) belövellő vér ballonszerűen felfújja a plakkot, és az elzárja a lument. Ugyanilyen plakkrepedés és vérbelövellés elindíthatja az érfal rétegeinek lapszerinti szétválását (dissectio) is.
-
2. Plakk-thrombosis esetén a rostos sapkát az áramló vér egészében magával ragadja (ún. usurált plakk), és a kifejezetten rögképző (thrombogen) zsírmaganyag szabaddá válva közvetlen érintkezésbe kerül a vérrel, és a véralvadás exstrinsic útjának beindításával rövid időn belül vérrög kialakulásához vezet.
7.2.7.: A plakk stabilitása
|
 |
A plakk stabilitásán morphologiai-klinikai-biológiai viselkedésének kiszámíthatóságát értjük. Stabil plakk az az érszűkületi falmegvastagodás, amelynek mechanikai, szerkezeti és ezzel együtt klinikai-biológiai viselkedésében hirtelen események, változások nem várhatók, azaz viszonyai stabilak, kiszámíthatók. Típusos képviselője a fibrosus plakk, illetve a fibroatheroma. Az instabil plakk mechanikai, szerkezeti és ezzel együtt klinikai viselkedésében nehezen prognosztizálható érfal-megvastagodás, amelynél hirtelen események (ún. plakk-szövődmények) és/vagy alakváltozások nem zárhatók ki, azaz viszonyai instabilak, nem jósolhatók. Típusos képviselője a nagy zsírmaggal rendelkező atheroma.
|
 |
A plakk klinikai-biológiai viselkedésén az általa érintett ér vérátáramlására gyakorolt hatását kell érteni: ha a plakk ebben váratlan ingadozásokat, mindenekelőtt csökkenéseket képes okozni, instabilnak hívjuk, ha viszont a plakk jelenléte a véráramlás hirtelen korlátozásával nem fenyeget, úgy a plakk stabil. A plakkok klinikai-biológiai, véráramlástani (hemodinamikai) viselkedése szoros összefüggésben áll morphologiai felépítésükkel, és az ebből közvetlenül levezethető mechanikai ellenálló-képességükkel.
Klinikailag ugyanis az instabil plakk veszélye abban áll, hogy éppen mechanikai képlékenysége folytán – a mindenkori véráramlástani viszonyoktól függően – hirtelen alakváltozásra képes, e morphologiai változékonysága pedig a maradék lumen fordított megváltozásával jár, és ez előidézhet olyan kedvezőtlen helyzetet, amelyben a maradék lumen rövid időn belül kritikus, vagyis az ellátott szövetek ischaemiás tűrőképességét meghaladó mértékben szűkül, és így az ellátott területen ischaemiás tünetek (pl. fájdalom – ld. angina pectoris, angina abdominalis, claudicatio intermittens, stb.), vagy akár definitív szövetelhalás (infarctus) következik be.
|
 |
A plakk szerkezeti stabilitása tehát közvetlen kapcsolatban és egyenes arányban áll klinikai stabilitásával, vagyis amelyik plakk szerkezetileg és mechanikailag stabil, az klinikai viselkedésében is az, és fordítva. A plakk szerkezeti felépítéséből tehát közvetlen következtetést lehet levonni az ellátott szövetterület, ezen keresztül pedig a beteg kilátásaira.
Stabilitás szempontjából tehát a plakkfejlődés így foglalható össze röviden: legkorábbi lényeges formája
-
(1) a zsíros csík (‘fatty streak’), amely a köztes formának minősülő
-
(2) praeatheromán keresztül két irányba fejlődhet:
-
(3-a) az instabil plakk (atheroma), majd ezen át a
-
(4) szövődményes elváltozások (plakk-bevérzés és -thrombosis) irányába; illetve
-
(3-b) a stabil plakk fejlődési irányának alaktani változatai
(fibrosus-meszes plakk, fibroatheroma) felé.
A plakk-instabilitás kockázati tényezői
-
1) a plakk szerkezete;
-
2) gyulladásos beszűrődés a rostos sapkában;
-
3) a rostos sapka mésztartalma.
1. A fentiekkel összhangban tehát a mechanikai szempontból nem ellenálló, ’puha’ összetevők (elsősorban az atheromás zsírmag) túlsúlya fokozza a plakk képlékenységét, instabilitását, és fordítva, minél nagyobb arányban szerepelnek mechanikailag ellenálló szöveti komponensek – elsősorban kötő- és hegszövet –, annál stabilabb a plakk.
2. Lobsejtek jelenléte, azok lyticus enzimjeinek útján, az alapstruktúrát károsítják, és gyengítik a plakk „fedelét” képező rostos sapkát, elősegítve a plakk sérülését.
3. Ha a rostos sapkában mész rakódik le, az késpengéhez hasonló lemezt alkot, amelynek éles széle a plakk és az érfal hullámzó mozgásai során egyszerűen belemetszhet a rostos sapka szövetébe, mechanikusan gyengítve azt, és így szintén hozzájárul a plakk sérüléséhez.
A plakk instabilitását fokozó egyéb tényezők közt mindenekelőtt figyelembe kell venni, hogy a szűkült szakaszon a felgyorsult véráramlás helyileg lecsökkent intraluminaris nyomással jár (Bernoulli-törvény), (KV_I_2_fejezet_2_hivatkozas) ez pedig egyfajta szívóhatásként hat a plakk „hátára”, a rostos sapkára. Prae- és poststenoticusan ellenkezőleg, lassabb áramlás és magasabb belső nyomás uralkodik, a peristenoticus falszakaszok ezért kifelé kitérnek. Ehhez járul még a merev érszakaszok és a szomszédos, rugalmas érfalrészek (ld. az erek szélkazán functioja) mozgékonyságbeli különbsége. Mindezen hatások éppen a plakk széli részeinek fokozott vongálódásához, mechanikus megterheléséhez vezetnek, ami a plakk sérülésének, berepedésének, bevérzésének, akár a fal rétegei szétválásának (dissectio) veszélyét hordozza magában.
7.2.8.: A szervek tartalékai az arteriosclerosissal szemben
|

Tanulmányozza a hivatkozás tartalmát!
|
Ha a scleroticus érszűkület elhúzódóan alakul ki, az időt ad a szervezetnek, hogy az ellátott szövetek túlélését segítő mechanismusok kifejlődjenek, azaz a terület teljes elvesztése (infarctusa) – rendszerint pl. olyan szöveti kompromisszumok árán, mint amilyen az idült ischaemiában kifejlődő intertsitialis fibrosis – elkerülhető legyen. Ez jelenti az érintett szövetek ischaemiás tűrőképességét lassan kifejlődő hypoxia esetén, amit segít az ellátó erek közti kapcsolatok (anastomosisok) kitágulása, illetve az egyébként jelentéktelen kollaterális érkapcsolatok kiépülése.
A Glagov-féle ún. kompenzatórikus értágulat értelmében pedig a plakk-képződéssel egyidejűleg az érintett érszakaszok tágulnak, külső körfogatuk nő, és ez egészen addig ellensúlyozza a plakk szűkítő hatását, amíg a plakk a lumen 40%-ának megfelelő nagyságúra nem nő, azaz eddig a fokig voltaképpeni szűkület nem alakul ki. Ez az adat jól korrelál azzal, hogy a lumen 50%-ának megfelelő plakk-nagyságig (azaz 50%-os szűkületig) csupán enyhe stenosisról beszélünk [szívinfarctus, coronaria szűkület]. Szélsőséges éhezésben, testsúlyvesztéskor a zsírban gazdag plakkok megkisebbednek.
7.2.9.: Az arteriosclerosis klinikai megjelenési formái
|
 |
Az érkeményedés legfontosabb klinikai tünete, hogy az érintett szerv, szövet keringészavarát működészavar követi. Így jöhet létre ischaemiás szívfájdalom (angina pectoris), szívinfarctus, agyi keringészavar, agyinfarctus. A bélrendszer ereinek megbetegedése vezet a morphologiai elváltozásokkal még nem járó, jellemzően 10-15 perccel étkezések után jelentkező, ischaemiás bélfájdalomhoz (angina abdominalis), illetve a már szövetkárosodást is jelentő erosiv-ulcerativ jellegű ischaemiás colitishez. Ha ez a keringészavar komplettálódik (pl. mesenterialis thrombosis), definitív bélinfarctus lehet a következmény. Az ischaemiás fájdalmak következő példája az alsó végtagok keringési korlátai miatt fellépő szakaszos járóképesség, a claudicatio intermittens (comb- és/vagy alszárfájdalmak jelentkezése járáskor, amelyek megállásra késztetnek).
|
 |
Az erek súlyos szűkületével a végtag elhalása, üszkösödése (gangraena pedis) alakulhat ki. Speciális tünetegyüttes a Leriche-syndroma: aortoiliacalis szűkület impotenciával. A veseerek érintettségével renovascularis arteriosclerosis, szekunder hypertonia fejlődik ki. Az érszűkület vidékén (pl. a. carotis elágazódás) kialakuló rendellenes (turbulens) áramlási viszonyokat hallgatózási zörej jelzi. A szűkület mögött meggyengülhet a pulsus.
7.2.10.: Az érkeményedés különleges és ritka formája: Mönckeberg-féle mediasclerosis
Jellegzetesen az alszár középnagy verőereinek mediájában diffúz vagy fokális meszesedés keletkezik. Különösen 50 év feletti cukorbetegek érintettek. Az elváltozás mésztartalma miatt radiológiailag kimutatható.
|
|