|
II./2.3.: Primer agyállományi tumor
II./2.3.1.: A központi idegrendszer elsődleges daganatairól általában
|
 |
A preparátum az intracranialis (ic) térfoglaló-térszűkítő folyamatok egyik legfontosabb formájának makroszkópos sajátságait demonstrálja: ebben az esetben a magának helyet foglaló neoplasticus folyamatról, primer agydaganatról van szó. Az agykoponyatérben előforduló tumorok két fő csoportra oszthatók (ugyanez igaz a gerincvelő daganataira is): lehetnek az idegszövet elemeiből kiinduló (primer) vagy máshonnan odakerülő, áttéti, metastaticus (szekunder) daganatok. A környezetből közvetlen úton az agyszövetbe törő malignus daganatokat a szisztémás patológia más fejezetei tárgyalják.
Az elsődleges agydaganatok átlagos gyakorisága 7-10/100 000 lakos. Különösen gyakoriak gyermekkorban (az összes tumorok közt a második leggyakoribb csoportot képezik ebben az életkorban), illetve egy második előfordulási gyakorisági csúcs tapasztalható a 45-70. életév között. Kóroktanuk javarészt ismeretlen, annak ellenére, hogy egyes fajtáik kialakulásában ismert pl. a családi halmozódás (ún. daganat-syndromák), környezeti ártalmak (meningealis daganatok kialakulása fej-nyak régiót ért sugárzás után), vagy az immunstátusz szerepe (primer cerebrális [rendszerint B-sejtes] lymphomák és az AIDS összefüggése).
II./2.3.2.: Az elsődleges agyállományi tumorok osztályozása
|
 |
A primer agydaganatok domináló többsége neuroectodermalis eredetű. Ebbe a csoportba tartoznak még a primer központi idegrendszeri (CNS – central nervous system) lymphomák, az agyburkok (dura mater, arachnoidea) daganatai is, stb., de ezekkel itt nem foglalkozunk. A neuroectodermalis tumorok első osztályozása Percival Bailey és Harvey Cushing nevéhez fűződik (1926). E két kiváló tudós cyto- ill. histogenetikai alapon kísérelte meg a daganatok osztályozását. Elképzelésük az volt, hogy a daganatok elemei – kiérési (differenciáltsági) fokuktól függő mértékben – emlékeztetnek arra a sejtre, amelyből származnak.
Így kézenfekvő volt, hogy a legfontosabb daganatok két fő csoportra oszthatók:
-
- glialis tumorokra (gliomákra): astrocytoma, oligodendroglioma, ependymoma; illetve
-
- idegsejt eredetű daganatokra („ganglion-sejtes” daganatok).
A daganatok keletkezésében megkülönböztetett szerepet tulajdonítottak cytogenetikailag – bár ők ezt az elnevezést nem használták – korai fejlődési állapotban lévő alakoknak (spongioblast, medulloblast, astroblast, stb.).
Az idegsebészeti technika fejlődésével egyre több tumortípust sikerült azonosítani, és az is kiderült, hogy a tumorok sokszor nem egyetlen fajta sejtből állnak, hanem egy-egy tumorban több sejttípusra emlékeztető elemek is előfordulhatnak (kevert gliomák [pl. oligoastrocytoma], glialis-neuronalis daganatok [pl. ganglioglioma]). Az osztályozás hosszú, kacskaringós úton fejlődött, ennek részletei ma már inkább tudománytörténeti jelentőséggel bírnak.
|
 |
A ma hivatalosnak elfogadott morphologiai (morphe – alak; morphologiai – alaktani) klasszifikáció a WHO 2007-ben megjelent beosztása, mely több mint száz daganattípust, illetve -altípust különít el. A szövettani osztályozás fejlődésének bizonyos mértékű egyszerűsödését jelentette a Kernohan-féle klasszifikáció. Kernohan a Mayo Klinika (Rochester, MN, USA) orvosaként korán átvette kollégájának Albert Brodersnek 1920-ban közölt elképzelését, amely szerint a daganatok klinikai viselkedése (biológiai potenciálja) legegyszerűbben egy numerikus skála segítségével írható le.
Broders a szájnyálkahártya eredetű rákokat négy csoportba (grádus) sorolta.
-
- Ha a daganatsejtek >75%-a hasonlított az ép nyálkahártya sejtjeire (azaz magasan differenciált alak volt), akkor ezt a daganatot I-es grádusúnak minősítette.
-
- Az 50-75% közötti hasonlóság II-es grádust (GrII.) jelentett,
-
- 25-50% közötti differenciált sejtarány határozta meg a III-as grádust (GrIII.),
-
- míg az alig differenciált (tehát jelentősen anaplasticus) daganatokat, ahol a sejteknek <25%-a hasonlít az eredeti szövetet/hámot felépítő) sejtekre, GrIV. csoportba sorolta.
Kernohan elképzelése, hogy ez a rendszer mechanikusan adaptálható az idegrendszer daganataira, hibásnak bizonyult. A négy kiérési (differenciáltsági) fokozat – módosításokkal – leginkább az astrocyter daganatokra alkalmazható (ezekre sem automatikusan), oligodendrogliomák, ependymomák között csak II-es és III-as grádus fordul elő. Az eredeti elképzelés is sokban módosult, hiszen ma már olyan sejtalakok (phenotypus) is a grádus-meghatározás alapjául szolgálnak, melyeknek ép, normális megfelelője nem fordul elő az idegrendszerben (ld. „pilocyta” – pilocytaer [„pilocytás”] astrocytoma). Az eredeti Kernohan-elképzeléssel szemben a mai szövettani értékelés a daganatos és a kiindulási alak hasonlóságán túl számos más, nem sejtalaktani, hanem szöveti szempontot is figyelembe vesz. Ezek közül a „körülírt” (GrI.) daganatoknak –astrocytoma pilocyticum – és a „diffúz”, azaz éles határ nélküli tumoroknak – gyakorlatilag az összes többi glioma – a 2000-es WHO beosztásban először alkalmazott elkülönítése kiemelkedő biológiai-klinikai jelentőségű. Fontos, hogy a különböző daganatcsoportok elkülönítésekor azok biológiai viselkedése (grádus) is szerepet kapott az osztályozásban. Ez legkönnyebben az astrocytaer gliomákon szemléltethető (1. táblázat).
|

Tanulmányozza át a táblázatban foglaltakat!
|
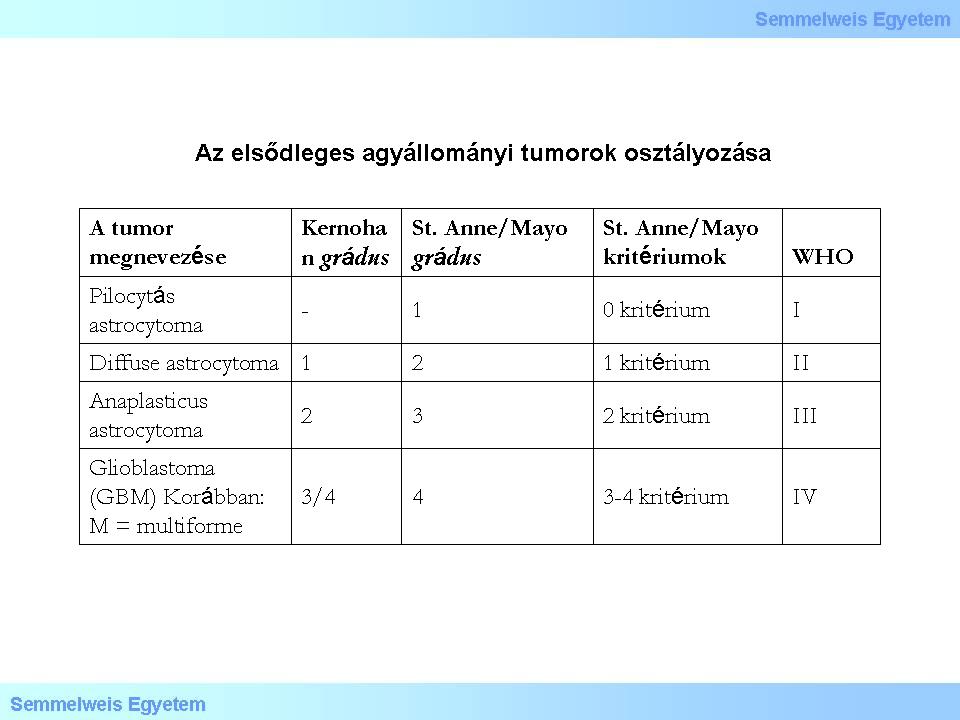
1. táblázat
|
A primer agyállományi tumorok kórjóslata (prognosis) elsősorban szöveti-cytologiai jellegzetességeiktől, illetve a kialakulásukat megelőző/kísérő molekuláris abnormitásoktól függ. Ezek közül legrégebben ismert a tumorsejtek „érettségének” jelentősége (ún. cytologiai differentiatio). Az elmúlt 5-10 évben előtérbe kezdenek kerülni a molekuláris/genetikai károsodások és a cytogenetikai eltéréseik. A differenciáltság (kiérés) fokának/mértékének – ún. grádus (az angol grade szó ugyanebből a latin szóból származik, ami „lépcsőt” jelent) – megítélését nehezíti az egy-egy tumoron belül rendszerint meglevő, akár szélsőséges szöveti sokféleség (heterogenitás). Emiatt pl. a széli részeken magasan kiérett glioma gyakorta rejt a nehezen hozzáférhető mély területekben differenciálatlan, anaplasticus tumort, glioblastomát (GBM). A szoros kórjóslati kapcsolat miatt a tumorok osztályozása a nehézségek ellenére is szöveti alapon történik. Pl. a legtöbbet tanulmányozott astrocytomáknál a kiérés fokának meghatározására négy ismérvet szokás – a szó valódi és átvitt értelmében egyaránt – „górcső alá venni”:
-
1) sejtmag-atypia,
-
2) kórsejttani változatosság (cytologiai pleomorphia),
-
3) osztódási aktivitás,
-
4) daganatsejtek által övezett glomeruloid endothelsejt-hyperplasia és/vagy necrosis (a tumorsejtek kerítéslécszerű elrendeződését [legtöbbször necrosist öveznek ebben a formában] nevezik pseudopalisad-képződésnek).
Ezek segítségével négy kiérési/differenciáltsági fokot (grádus/grade) állapítanak meg:
-
- GrI (grade I) – ha a tumorban egyik ismérv sincs jelen;
-
- GrII – ha a tumorban a négy közül egy;
-
- GrIII – ha kettő;
-
- GrIV – ha három felismerhető.
Ez a felosztás eredetileg az ún. Saint Anne-Mayo klasszifikáció alapjául szolgált. Ezt követően a WHO egymást követő osztályozásai változtattak rajta, de az alapelvek ma is jobbára elfogadhatóak. A glialis daganatok biológiai viselkedését a nagyfokú infiltratív hajlam határozza meg. Ma I-es grádusú tumor kórisméje ritkán állítható fel és ezekre a formákra a körülírt („expanzív”) növekedés jellemző. Ezzel ellentétben, minden magasabb grádusú forma diffúz módon növekszik.
További fontos tényező, a klinikai kórlefolyást alapvetően meghatározó sajátság a tumor anatómiai elhelyezkedése. Az utóbbi diagnosztikus értékű lehet olyan tumoroknál, amelyek meghatározott helyen szoktak megjelenni (localisatiós predilectio). Ugyanakkor ismertté vált, hogy a localisatio a daganat molekuláris „ujjlenyomatát” is meghatározza: a frontalis lebenyben kifejlődő GBM sokszor más sajátságokkal bír, mint ugyanez a megjelenésű (phenotypus) GBM az occipitalis lebenyben! Egyéb kedvezőtlen körülmények miatt szövetileg „benignus, differenciált” (jó prognózisú) tumor is lehet akár rövidtávon is halálos (pl. a hátsó koponyagödör meningeomái, a IV. agykamra fenekén növekvő, jól differenciált ependymoma, stb.). A tumorok mind térfoglalást (térszűkítő folyamatot) jelentenek, növekedésükkel a koponyaűri nyomás is nő .
Az idő és a tumornövekedés előrehaladtával a daganatszövet csaknem mindig dedifferenciálódik. Ugyanakkor jellegzetes, hogy még a dedifferenciáltabb intracranialis tumorok is csupán kivételesen adnak extracranialis áttéteket; biológiai agresszivitásuk az igen kifejezett kiújulási (recidiva) hajlamban rejlik. A központi idegrendszeri elsődleges daganatok osztályozása a WHO 2007-ben közzétett rendszere szerint történik, ám mára már a 2007-es WHO is tulajdonképpen elavult.
II./2.3.3.: A primer agytumorok onkogenezise
|
 |
A daganatok elnevezése azt sugallja, hogy a tumor valamilyen véglegesen elkötelezett alakból származik. Jellegzetes példa erre az „oligodendroglioma” elnevezés. Ez elméleti szempontból számos kérdést vet fel, mindenekelőtt, hogy valóban oligodendrocytából származik-e ez a daganat. Közben fény derült arra, hogy a teljesen kifejlett humán agy bizonyos területeiben osztódásra képes, pluripotens (progenitor) sejtalakok találhatók. Ezek egy része biztosan szerephez jut a glialis, illetve neuroectodermalis tumorgenezisben. Ma azt is tudjuk, hogy a DNS károsodásai eddig elképzelhetetlennek tartott sejtszintű jelenségekre adhatnak lehetőséget: mesenchymalis-epithelialis/epithelialis-mesenchymalis transzformáció (MET és EMT), vagy ún. regresszív differenciáció, vagyis a megállapodott sejtalakok retrográd átalakulása, aminek fényében nem zárható ki az a bizarr lehetőség, hogy egy oligodendrocyta genetikai károsodása dedifferenciációhoz és ennek következtében daganat kialakulásához vezethet. Egy viszonylag friss (2010) közleményből átvett ábrán (1.ábra) lehet szemléltetni, hogy ma miként képzeljük el a glioma genesis lehetséges útvonalait. A szaggatott nyilak arra utalnak, hogy még mindig sok a bizonytalanság ezen a területen. Az is említésre méltó, hogy az ábrán nem találjuk az ependymomák lehetséges kialakulási útvonalait!
|

Tanulmányozza a folyamatábrát!
|
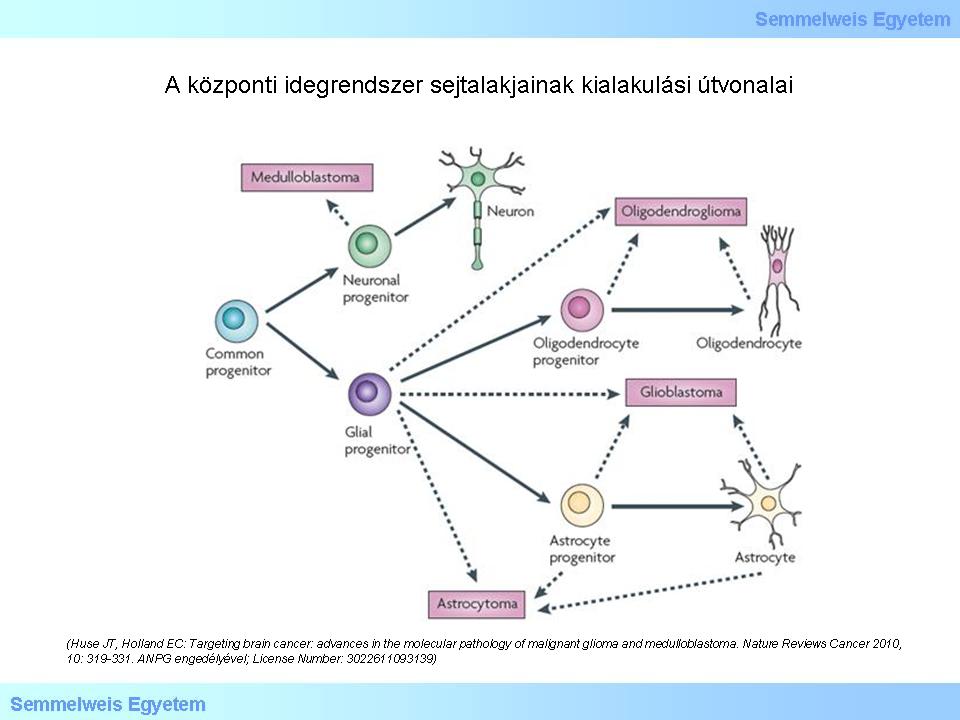
1. ábra: A központi idegrendszer (central nervous system, CNS) sejtalakjainak kialakulási útvonalai. (Huse JT, Holland EC: Targeting brain cancer: advances in the molecular pathology of malignant glioma and medulloblastoma. Nature Reviews Cancer 2010, 10: 319-331. ANPG engedélyével; License Number: 3022611093139)
|
Az ábrán vázolt elképzelés szerint közös progenitor sejtből származnak a különböző irányba differenciálódó alakok. Ha a pluripotens sejtből (nem „őssejt” a szó igazi értelmében) kiinduló, osztódások során zajló differenciáció folyamatában genetikai károsodás történik, akkor ennek eredménye korlátlan osztódás („immortalisatio”) lehet, ami daganat kialakulásához vezet. A korszerű genomikai elemzés feltárta azokat a molekuláris útvonalakat, amelyek a legtöbb glioma kialakulásáért felelőssé tehetőek. A GBM genom vizsgálatát ismertető közlemény 2008-ban jelent meg. Tisztázódott, hogy receptor kinázok (RTKs), mint az epithelialis növekedési faktor (EGFR) és a thrombocyta-eredetű növekedési faktor (PDGFR) génjeinek mutációja nagyon fontos a gliomagenesisben. A növekedési faktorok közreműködése a PI3K-AKT-mTOR és a RAS-MAPK szignalizációs rendszeren keresztül fejti ki onkogenetikus hatását. Az alábbi ábrán az is látható, hogy a p53 és RB szuppresszor útvonalak defektusai hasonlóképpen lényegesek. A gének károsodása abnormis fehérjéket eredményez. A kóros fehérjék kimutatása lehetőséget teremt a gliomák (elsősorban a glioblastoma) altípusainak elkülönítésére. A 2. ábrán az EGFR-t piros, a PDGFR-t kék és az NF1-et zöld szín jelzi. Az is látható, hogy a tumorgenesisben az általános onkológiából és a sejtosztódási ciklus leírásából ismert más molekuláknak is fontos szerep jut.
|

Elemezze az ábrán látottakat!
|
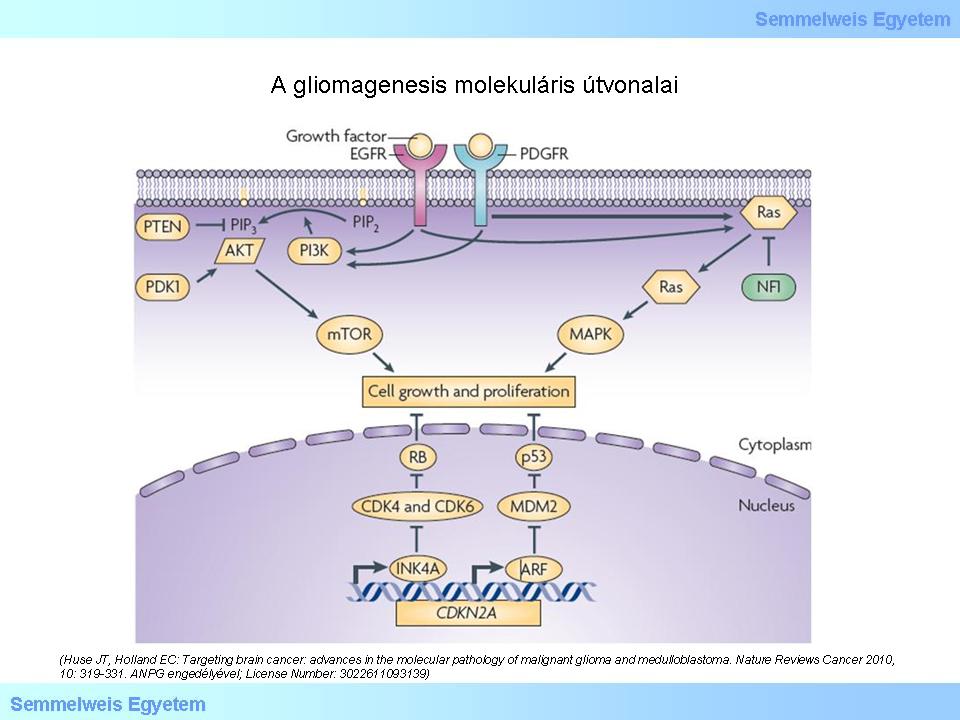
2. ábra: A gliomagenesis molekuláris útvonalai. CDK: cyclin-dependens kináz. NF1: neurofibromin. PDK1: 3-foszfoinozitid-dependens protein kináz. PIP2: foszfatididilinozitol-4,5-biszfoszfát. PIP3: foszfatidilinozitol-3,4,5-triszfoszfát. (Huse JT, Holland EC: Targeting brain cancer: advances in the molecular pathology of malignant glioma and medulloblastoma. Nature Reviews Cancer 2010, 10: 319-331. ANPG engedélyével; License Number: 3022611093139)
|
A WHO 2007-ben megjelent “Kék könyve” már előrevetítette ezeknek az útvonalaknak a jelentőségét. Ezt a sematikus ábrát látjuk alább (3. ábra), amelyből az is kiderül, hogy az egyik útvonal klasszikus „genetikai/biológiai progresszió” (GrII. – GrIII. – GrIV.), ez jellemzi a másodlagos (szekunder) glioblastomát. Más útvonalat követ az elsődlegesen GBM-ként megjelenő daganatok csoportja.
|

Elemezze a folyamatábrn látottakat!
|
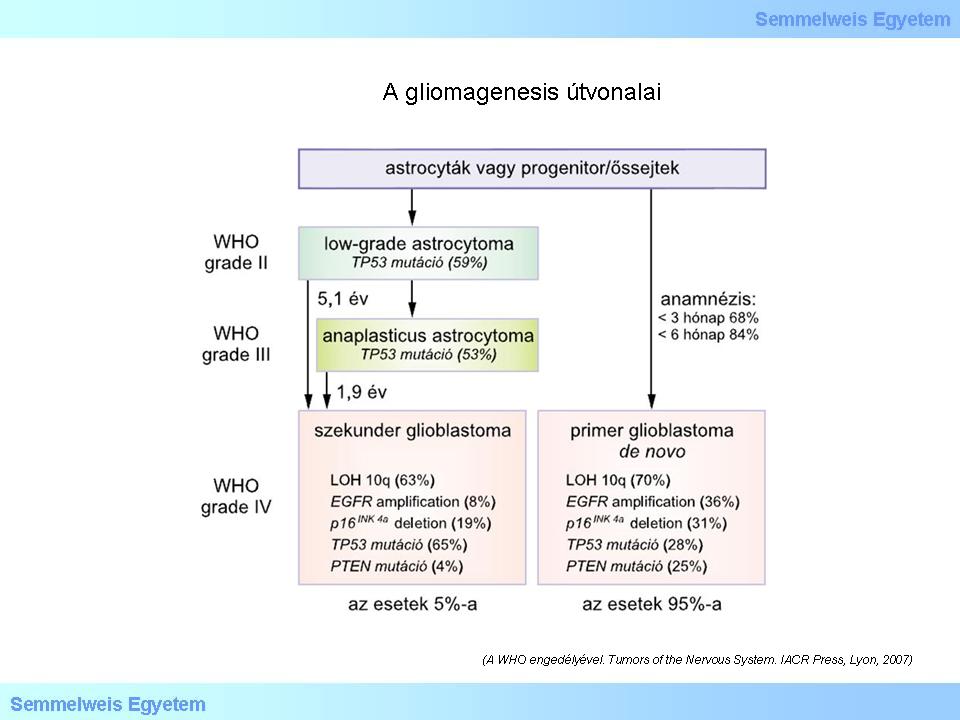
3. ábra: A gliomagenesis útvonalai. (A WHO engedélyével. Tumors of the Nervous System. IACR Press, Lyon, 2007).
|
A genetikai útvonalak (részletes magyar nyelvű tárgyalását ld. a Kásler Miklós által szerkesztett Klinikai Onkológia tankönyvben) feltérképezése közben – csaknem „melléktermékként” – derült fény arra, hogy a gliomák nagy részében az első és közös abnormitás egy metabolikus enzim (izocitrátdehidrogenáz-1: IDH-1) génjében jelentkezik. Az IDH-1 cytoplasmaticus enzim, a missense pont-mutáció az R132 lokalizációban (az enzim aktív centruma) jelentkezik.
Ma már ismert, hogy ritkábban a mitochondrialis IDH-2 enzim R172-helyén is kialakulhat pontmutáció. Az IDH-1/IDH2 mutációk elsősorban az alacsonyabb grádussal jellemezhető gliomákban jelennek meg a daganat kialakulás korai fázisában. Ha ezt a mutációt az 1p19q génrészletek deléciója/ko-deléciója követi, akkor a daganat oligodendrogliomaként viselkedik és sokszor – bár nem minden esetben – megjelenése is ennek felel meg. Ha a második lépés a P53 mutáció, akkor anaplasticus (GrIII.) astrocytoma, később szekunder glioblastoma (GrIV. GBM) fejlődik ki. Az IDH mutáció jelentősége abban rejlik, hogy ez a cytoplasmikus enzim a lipidszintézis, az oxidatív stressz elleni védőmechanizmusok, az oxidatív sejtlégzés és az oxigén-szenzor szignál-transzdukció kulcsmolekulája.
|
 |
Jelenleg is folyik a vita arról, hogy az IDH-1 által katalizált folyamat metabolitja (2HG = 2-hidroxiglutarát) milyen mechanizmus útján hat az agytumorok és a felnőttkori akut leukaemiák keletkezésére. A diagnosztikában ma már kötelező a mutáns IDH-1 fehérje jelenlétének immunhisztokémiai vizsgálata, illetve ha a daganat megjelenése oligodendroglialis sejtek jelenlétére utal, akkor kötelező az 1p19q FISH vizsgálat is. A genetikai vizsgálatok alapján a GrIV. gliomákat (glioblastoma) ma négy altípusra osztják. Ezeknek az altípusoknak a beteg túlélését meghatározó prognosztikai jelentősége van. Az 1p19q LOH és az MGMT (metilguanin-metiltranszferáz) enzim gén promoter szakaszának metilációs foka viszont „prediktív” markerek. Ez utóbbiak ugyanis jelzik, hogy a daganat milyen gyógyszeres kezelésre reagál (1p19q LOH esetében a PCV, míg MGMT metiláció fennállásakor alkiláló szer [Temodál] alkalmazása javasolt.). Ezeknek a részleteknek tárgyalása meghaladja ennek a fejezetnek a korlátait (2. táblázat).
|

Tanulmányozza az ábrát!
|

2. táblázat: A jelenlegi elképzelés szerint négy malignus glioma altípus létezik: (1) proneuralis; (2) mesenchymalis; (3) klasszikus; (4) neuralis. Ezek molekuláris pathogenesise és klinikai lefolyása eltérő. A pontos részletekre irányuló kutatások a mai neuro-oncopathologia élvonalát képviselik. (Huse JT, Holland EC: Targeting brain cancer: advances in the molecular pathology of malignant glioma and medulloblastoma. Nature Reviews Cancer 2010, 10: 319-331. ANPG engedélyével; License Number: 3022611093139)
|
II./2.3.4.: Astrocytomák
II./2.3.4.1.: Általános jellegzetességek
|
 |
Bármely életkorban és lokalizációban előfordulhatnak. Többségük infiltratív módon növekszik, egészben (in toto) nem lehet őket eltávolítani. A tumorszéleken kialakuló reaktív astrocytosis még a legmodernebb vizsgálómódszerekkel is nehezen különíthető el a daganatos astrocyta-burjánzástól, vagyis a neoplasticus és reaktív területek határa sokszor szétválaszthatatlanul elmosódik. Ebben esetenként az IDH-1 immunhisztokémiai vizsgálat (ld. feljebb) segíthet. Intraoperatíve fluorescens festékkel sikerülhet a daganatos és ép rész határát megtalálni. Kezelésüket nehezíti, hogy különösen a jól differenciált – magasan kiérett – daganatok vidékén a vér-agy (vér-tumor) gát módosult formában működik, és éppen a vízoldékony chemotherapiás szerek nem jutnak át. Sajnos a glialis eredetű daganatok gyakorta kevéssé sugárérzékenyek. Vagyis: a sebészi kezelés nem tudja a tumort maradéktalanul eltávolítani, és a chemo- és radiotherapiás modalitások sem hatékonyak a tumor eradikálásában, ami e daganatok végső soron kedvezőtlen kórjóslatát indokolja: a diffúz malignus gliomák legrosszabb indulatú (és sajnos igen gyakori) formájában – glioblastoma – szenvedők átlagos túlélése a legmodernebb kezelések ellenére sem haladja meg a 12-14 hónapot. Ebből a szempontból áttörést hozott a gliomák molekuláris „ujjlenyomatának” rohamosan fejlődő tisztázása. Azokban az esetekben, ha a daganatban egyidejűleg megtalálható az IDH1/IDH2 mutáció és az NGNT enzim gén promoter szakasza metilált, a kombinált chemo- és radiotherapia (ún. Stupp protokol) egyre nagyobb számban tesz lehetővé akár 2-4 éves túlélést is!.
II./2.3.4.2.: Magasan differenciált (alacsony grádusú; GrI.) astrocytomák
|
 |
Sokszor semmilyen radikális kezelést nem igényelnek. Lassan nőnek, s lokalizációtól függően sokáig tünetmentesek. Ide tartoznak a gyermekkori n. opticus- és chiasma opticum-eredetű astrocytaer gliomák, és a cerebellaris astrocytomák. Az elsődleges szövettani diagnózishoz szükséges szövetmintát UH- vagy CT-vezérelt sztereotaxiás biopsiás mintavétellel szokás nyerni. A GrI-es astrocytomák ún. pilocytás daganatok. A cerebellaris pilocytás astrocytoma pathognomikusan és már képalkotókkal is érzékelhetően tömlős tumor, amelyben a cysta üregébe a tumoros massza beboltosul („fali csomó”). Lenyomati keneteiben viszonylag monomorph, hosszúkás, orsó alakú, bipoláris sejtek láthatók hosszú nyúlványokkal, kerekded-tojásdad magokkal, amelyek finomrögös chromatin állományt tartalmaznak. Számottevő sejt-, illetve magpolymorphia nincs. A tumorok egy része sebészileg irtható, ilyenkor a prognózis kiváló. (Megjegyzés: A WHO 2007-ben megjelent útmutató könyvében felsorolt, a pilocytaer astrocytomákban megengedett morphologiai abnormitások zavaróan átfedésbe hozhatók a GBM jellegzetességeivel – a diagnózis távolról sem olyan egyszerű, mint ahogy a didaktikus szempontból egyszerűsített leírások alapján gondolni lehetne!)
II./2.3.4.3.: Diffúz (közepesen/jól differenciált; GrII.) astrocytomák
E csoportban (15P-1. makrokép; 15P-1. mikrokép) megkülönböztetnek fibrillaris, protoplasmaticus és gemistocytás szöveti formákat. Fontos tulajdonságuk az onkológiai értelemben vett progresszióra (a kiérés fokozatos elvesztésére, dedifferenciálódásra) való hajlam. Ez a klinikai/biológiai/molekuláris értelemben vett progresszió, azaz a genetikai hibák folyamatos akkumulációja nem tévesztendő össze a radiológiai progresszióval, amit a daganat nagyságbeli növekedésére szoktak alkalmazni!
|

Tanulmányozza a képeket!
|
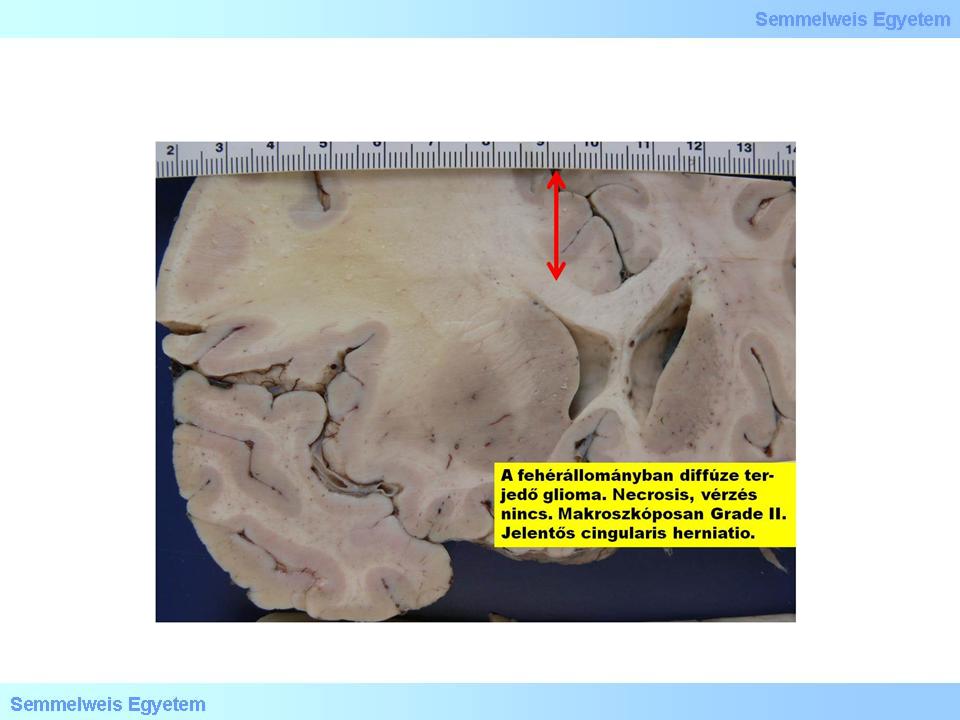
1. makrokép: A fehérállományban diffúze terjedő glioma. Necrosis, vérzés, nincs – ezért makroszkópiája alapján a tumor GrII.-es kiérési fokú –, szemben az éppen ezek miatt tarka képű GrIV.-es glioblastomával. Jelentős cingularis herniatio- és középvonali (ld. a piros nyilat!) áttolódás. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
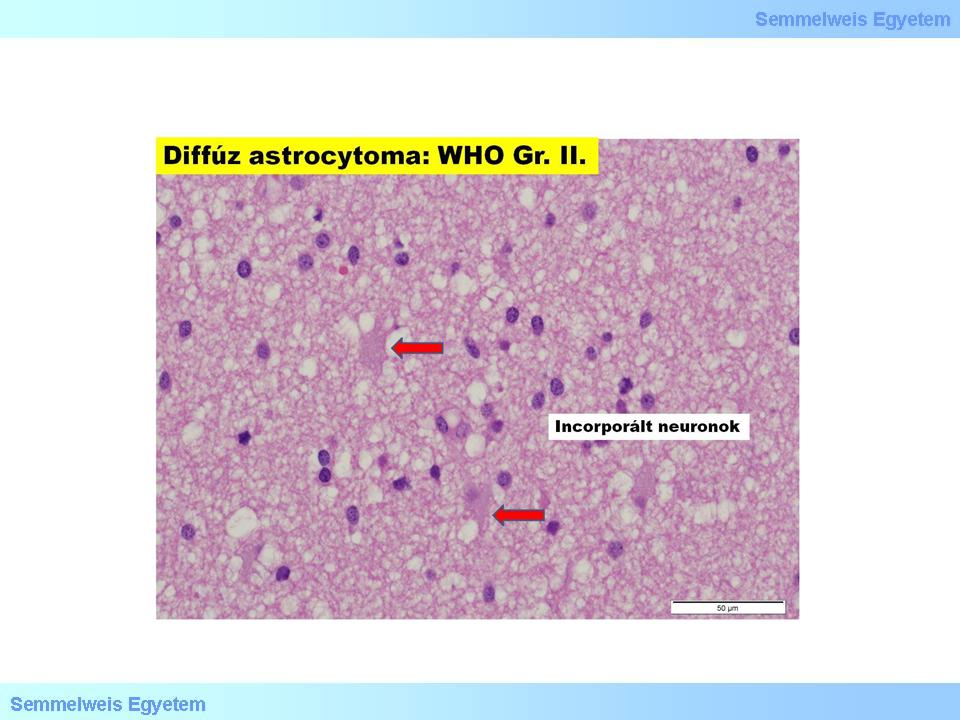
1. mikrokep: Diffúz astrocytoma (GrII.). (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
A biológiai progresszió során a tumor szövetileg egyre kevésbé hasonlít kiindulási önmagára, malignitása, biológiai agresszivitása nő. Így alakulhat ki egy GrII-es tumorból elébb GrIII-as (anaplasticus astrocytoma), majd GrIV-es (glioblastoma multiforme) fokozatú daganat. A fibrillaris astrocytomára szövetileg a minimálisan emelkedett sejttartalom (cellularitás), a sejtek mérsékelt változatossága, a magok mérsékelt hyperchromasiája, egyszersmind a szerkezet rendezetlensége, a tumor infiltratív terjedése jellemző. Az esetlegesen jelentkező fokozottabb sejtmagatypia még nem növeli a grádust. Mitotikus alak nem, vagy igen elvétve látszik, necrosis, endothel-proliferatio nincs.
A gemistocytás astrocytoma diagnosztikus kritériuma, hogy a tumorsejtek legalább 20%-a gemistocyta legyen. E sejtek voltaképp duzzadt astrocyták, amelyek nem neoplasticus, reaktív jelleggel az agy heveny és idült károsodásaiban is megjelenhetnek, neoplasticus jelleggel pedig az astrocytomáknak ebben az alcsoportjában szerepelnek. Nagy, eosinophil sejttesttel (cytoplasma), szélre helyezett maggal rendelkeznek (a sejtek neve állítólag a német „hízlalt, hízott – gemästet” szóból ered), közöttük fibrilladeris mátrix. A sejtdússág (cellularitás) mérsékelten emelkedett (15P-2A. mikrokép). A sejtek intenzív pozitivitást mutatnak GFAP-ellenes immunhisztokémiai reakcióval (15P-2B. mikrokép), elektronmikroszkóppal tömeges intermedier filamentum és gyakran megamitochondriumok jellemzik. Sajátságuk, hogy progresszióra hajlamosak, ami robbanásszerűen is bekövetkezhet, de ennek idejére a morphologia alapján nem tudunk következtetni.
|

Tanulmányozza a képeket!
|
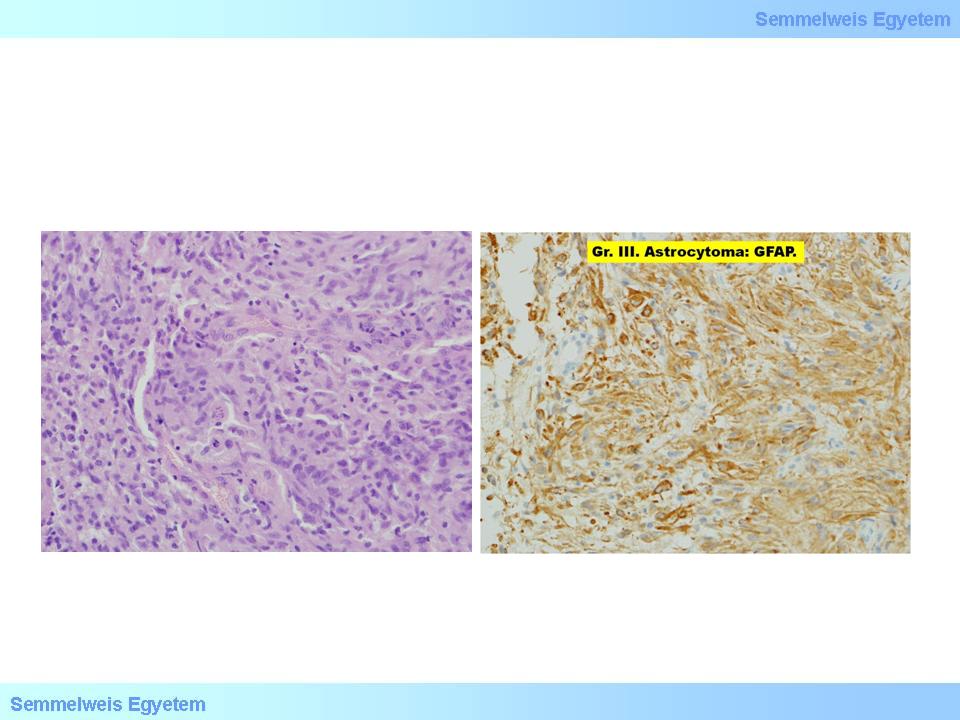
2A-B. mikroképek: A: Astrocytoma – a középső látómezőben két nagy sejtalak (gemistocyta). B: A daganat erős GFAP-pozitivitást mutat. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
II./2.3.4.4.: Anaplasticus astrocytomák (GrIII.)
Szövetileg a diffúzan növekvő tumor sejtdússága, a sejtek kifejezett magatypiája, a sejtmagok hyperchromasiája, a fokozott mitotikus aktivitás jellemzi. Az astrocytomákra általában jellemző heterogenitás itt erőteljesen nyilvánul meg: a mag és a sejttest alak-, nagyság- és festődésbeli különbségei, a sejtosztódási ráta emelkedése kifejezettek. A mitotikus aktivitás korszerű meghatározására a foszfohiston3 (PPH3) immunhisztokémiai reakció automatikus kiértékelése (x/1000 sejt) a legalkalmasabb. Kevésbé megbízható a Ki-67 ellen termelt antitest (Mib-1) használata. A progresszió előrehaladtával a szöveti kép egyre agresszívebb, többmagvú sejtalakok, bizarr sejtmagok jelennek meg, a magban zárványok és feltűnő sejtmagvacskák látszanak, elszórtan gemistocyták fordulhatnak elő.
Ebben a tumorcsoportban nincs necrosis, endothelproliferatio, glomeruloid capillaris proliferatio (összefoglalóan „microvascularis proliferatio”: MVP). A sokszor környezetüktől némileg eltérő, tömör/compact sejtcsoportok klonogen szubpopulációk kialakulását jelezhetik. A daganatos sejtpopuláció klonális szelekciója (azaz az életképesebb sejtcsoportok túlélése egy adott mikrokörnyezeti miliőben) eleddig ismeretlen okból indul el, de a folyamat során a kiválogatódó klónok túlnövik a környezetük rendszerint kiérettebb, ám kevésbé szapora daganatsejt-változatait. Végül gyakorlatilag a legkevésbé differenciált tumorforma (a glioblastoma multiforme) egyedül marad, és végbemegy a teljes daganat dedifferenciációja, azaz az onkológiai progresszió.
II./2.3.4.5.: Glioblastoma (multiforme) (GB[M], GrIV.)
A központi idegrendszer legrosszabb indulatú daganatai közt tartjuk számon, kezelés hiányában csupán néhány hónapos (6-9) túléléssel lehet számolni, de sajnos a legkorszerűbb kombinált kezelésben részesülő betegek túlélése sem több 10-14 hónapnál. Szabad szemmel a tumor határa sokszor megtévesztően éles (2. makrokép), miközben valójában infiltratív daganatról van szó, azaz az éles kontúrok ellenére sem áttéttel van dolgunk. A kiterjedt necrosisokra (2. fotó), s ezáltal a tumorparenchyma aberráns érhálózatából származó nagy területű bevérzésekre való hajlama miatt a makroszkópos kép gyakran utánoz agyvérzést (3A-C. makrokép), a klinikai kép pedig szélütés-syndromát (stroke).
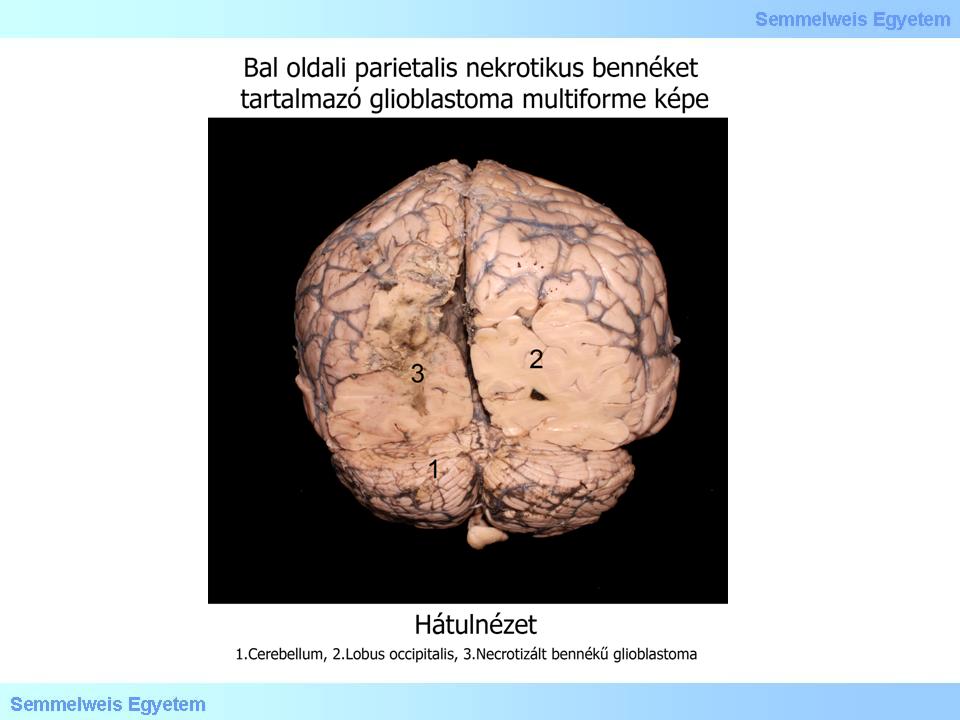
2. fotó: Glioblastoma multiforme – Molnár Attila és Balogh Attila
|
|

Elemezze a képeken látható jellegzetességeket!
|
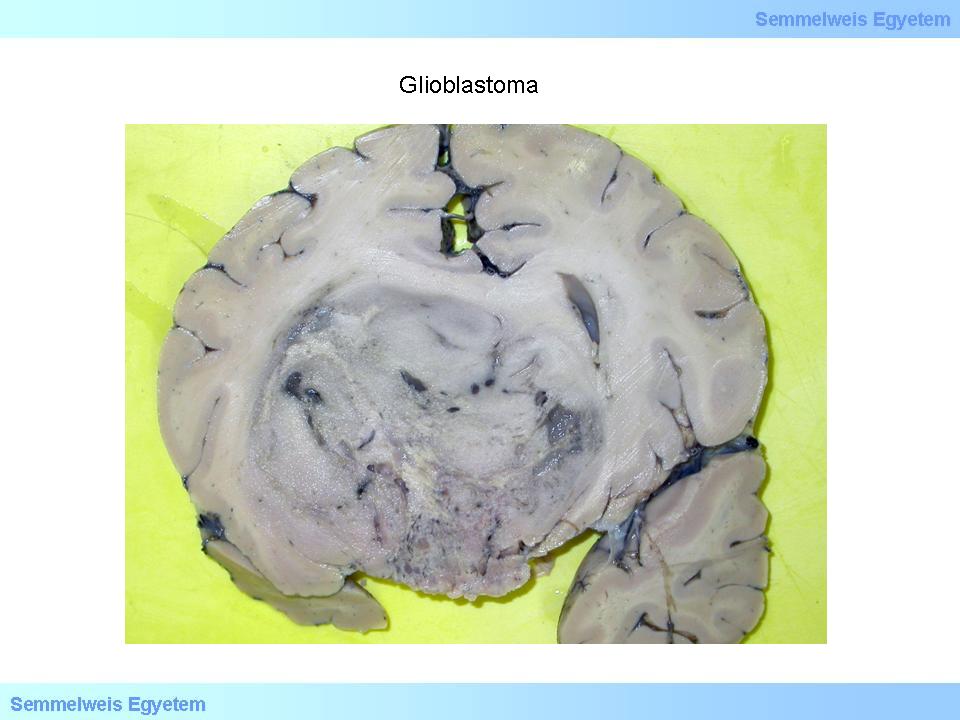
2. makrokép: A glioblastoma határainak makroszkóposan éles jellege megtévesztő, hisz szövetileg infiltratív daganatról van szó. Ez a tumortömeg komoly agyállományi deformációt okozott. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
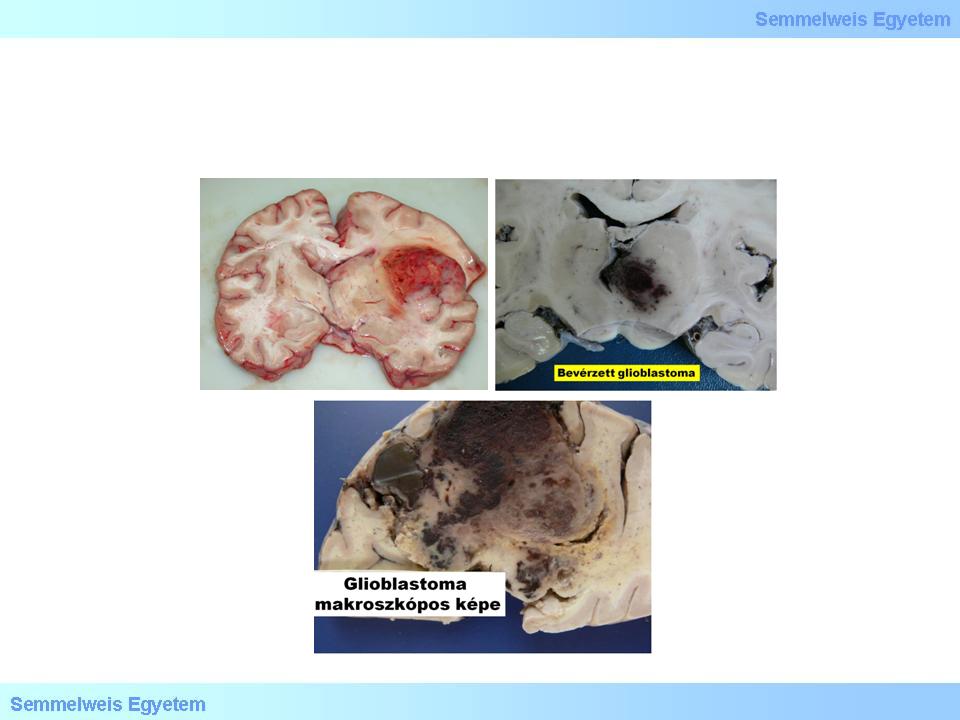
3A-C. makroképek: A bevérzési hajlam miatt a glioblastoma multiforme metszlapi makroszkópos megjelenése tarka, gyakran utánoz agyvérzést. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
A tumornak elsődleges és másodlagos formája létezik. Az elsődleges (primer) glioblastoma multiforme de novo alakul ki, míg az ún. másodlagos (szekunder) GBM alacsonyabb grádusú astrocytomák biológai progressziójának eredménye. A glioblastoma (multiforme – ezt a jelzőt ma már alig használjuk, mert ismertek monomorph glioblastoma- altípusok, mint pl. az ún. kissejtes glioblastoma) vagy pluripotens progenitorsejtek proliferatiojának, vagy érettebb tumoralakok progesszív dedifferenciálódásának az eredménye. A WHO-2007 által javasolt diagnosztikus kritériumok szövetiek: necrosis az azt övező pesudopalisaddal (kerítéslécszerűen elhelyezkedő daganatsejtek) és/vagy MVP. Ezek mellett megtalálhatóak az anaplasticus astrocytomák leírásában taglalt cytológiai eltérések. A vitalis tumorszövet sejtdús (hypercelluláris), a sejtek anaplasticusak, differenciálatlanok (3. mikrokép), az alapállomány spongiform (microcysticus) vagy fibrillaris.
|

Tanulmányozza a képen látható szövetet!
|

3. mikrokép: A glioblastoma szöveti képe: anisonucleosis, hyperchromasia, endothelproliferatio. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
II./2.3.5.: Oligodendrogliomák
II./2.3.5.1.: II-es grádusú oligodendrogliomák (OGDG, GrII)
Makroszkóposan jellegzetesen féltekei (hemispherialis) lokalizációjú, sokszor meszes daganat, amely dominálóan a kéregben, illetve a kéreg alatti fehérállományban keletkezik, és a kérget kiterjedten infiltrálja. Ez a szöveti képben az idegsejteket körülvevő csoportos tumorsejt-invasio – ún. daganatos satellitosis – képében követhető nyomon (4. mikrokép). A szabad szemmel vizsgált metszlapokon éppen ezért a kéreg-velő határ nem ismerhető fel, a daganatszövet határa is elmosódó, feltűnő és jellegzetes azonban a többgócú meszesedés, és az ugyancsak gyakori intratumoralis vérzés. A metszlap néha kocsonyás, csillogó (4. makrokép): ennek hátterében „myxoid degeneratio” áll. Ez részben nyákszerű, PAS+ anyagot accumuláló oligodendroglia-sejtek megjelenésére vezethető vissza (utóbbiakat mucocytáknak nevezték), illetve a sokszor microcysticus intercellularis mátrixban lerakódó nyákanyag következménye.
|

Tanulmányozza a képet!
|
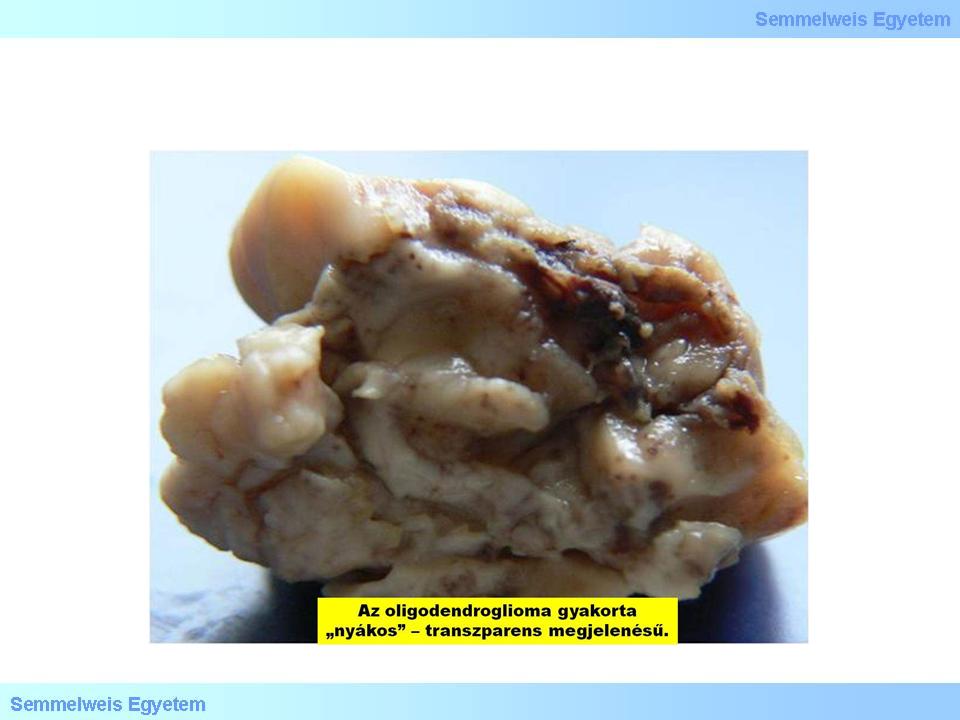
4. makrokép: Az oligodendroglioma gyakorta nyákos-csillogó megjelenésű. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
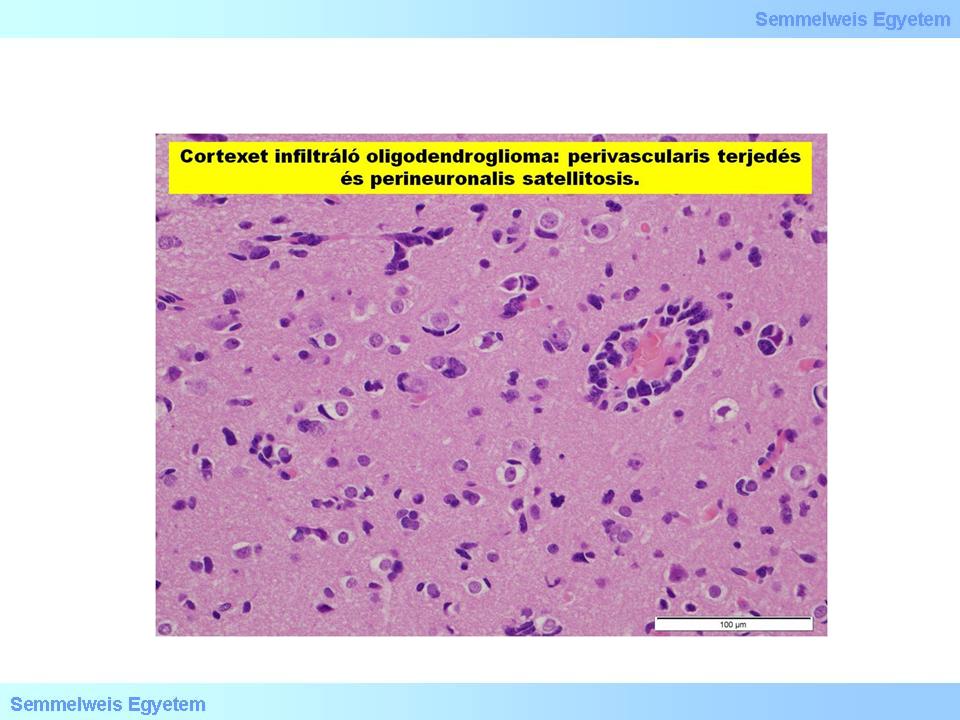
4. mikrokép: A cortexet infiltráló oligodendroglioma: perivascularis terjedés, perineuronalis satellitosis. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
Diagnosztikus értékűek az ún. „minigemistocyták”: élénk eosinophil cytoplasma, excentrikus mag és a fent leírt gemistocytáknál kisebb átmérő jellemzi őket. Az oligodendrogliomákban is elkerülhetetlen a kiérés folyamatos elvesztése (dedifferenciálódás) a jól differenciáltnak számító GrII-es tumoroktól az egyértelműen malignus és agresszív viselkedésű, GrIII-as, anaplasticus formákig, de e tumorvonalból glioblastoma multiforme nem keletkezik. A GrII-es tumorok szöveti képében ún. dróthálóerek, monomorph sejtmagok, a tumorsejtekben mag körüli optikailag „üres” cytoplasma (ún. perinuclearis halo) és extracellularis meszesedés látható. (Megjegyzés: A „halo” görög szó, a nyomtató ló járatásakor követett köralakú pályát jelenti – innen származik a festészetből jól ismert, a szentek fejét övező fénykoszorúra használt gloria/halo kifejezés is!) Az oligodendrogliomák 50%-a GFAP pozitív, ami annak köszönhető, hogy fejlődésük egy korai fázisában a tumorsejtek GFAP termelésre képesek.
II./2.3.5.2.: Anaplasticus (malignus) oligodendrogliomák (GrIII)
|
 |
A legfontosabb alaktani (morphologiai) novum a necrosisok kialakulása, a magas sejtmag-sejttest arány és a megjelenő sejtatypia, amivel óhatatlanul hypercellularitás is együtt jár. Az ugyanakkor fokozott osztódási aktivitás és vascularis endothelproliferatio (MVP) egyszersmind az agresszívvá váló daganat szöveti jele. E tumorforma hajlamos a liquor-űrtereket masszívan beszűrni, ellentmondásos módon épp az invazív sejtklón jól differenciált, nem anaplasticus, mindenesetre ez a folyamat hamar végzetes kimenetelbe (hydrocephalus internus, herniatio tonsillarum cerebelli) torkollhat.
II./2.3.5.3.: Oligoastrocytomák
A neuro-onkopathologia leginkább vitatott, nagyon szubjektív kategóriát jelentenek a kevert gliomák, az oligoastrocytomák. Ezeknek is két grádusa (Gr.II. és Gr.III) ismert. A Gr.III. oligoastrocytomákban (Gr.III. OA) a glioblastoma minden szöveti- és cytológai jellemzője megtalálható, de egyidejűleg vagy diffúz eloszlásban, vagy ritkábban jól elkülönülve, perinuclearis haloval jellemezhető elemek is felismerhetőek. Ez a kritérium nagyon függ a vizsgáló patológus tapasztalataitól és egyéni megítélésétől. Ennek elkerülésére próbálkoztak a „glioblastoma oligodendroglialis komponenssel” kategória meghonosításával. A kérdés azért kezd érdektelenné válni, mert nagy retrospektív és prospektív vizsgálatok azt bizonyítják, hogy ennek a sejtösszetételnek jelenléte vagy hiánya a betegek túlélését nem befolyásolja (EORTC, 2012).
II./2.3.6.: Ependymoma (GrII)
Az ependymoma makroszkóposan általában élesen körülírt, ritkábban infiltráló, lágy, szürkésvörös-szürkésfehér, helyenként bevérzett, illetve cysticus, necroticus, lassan növekvő, általában a kamrák falából kiinduló daganat. A „klasszikus” megjelenési forma a IV. agykamrában a leggyakoribb, a gerincvelőben jobbára intramedullaris tömeg. Több szöveti típusa van. A szövettani képben általában jellegzetes a perivascularis pseudorosetta, vagyis a tumorsejtek körkörös elrendeződése erek körül úgy, hogy nyúlványaik az érfalhoz húzódnak, ezáltal perivascularis sejtmagmentes udvar alakul ki, ami átnézeti képben finoman fibrillaris, eosinophil foltozottságot eredményez. E perivascularis fibrillaris udvar intenzíven GFAP-pozitív. Az átnézeti kép sokszor könnyebben elvezet a diagnózishoz, mint az erős nagyítás, éppen a pseudorosetták dominanciája miatt.
|
 |
További jellemző és értékes szöveti jel a valódi ependymalis rosetta. Ezekben – és az ún. „ependymális canalisokban” – a megnyúlt tumorsejtek egy központi helyzetű lumen körül rendeződnek (visszaidézik a primitív velőcső szerkezetét). Utóbbiak ritkábbak, mint a pseudorosetták. Ismert az ependymomák anaplasticus formája (GrIII) is, amelyben a kórsejttani és kórszövettani éretlenség (anaplasia) jelei mellett emelkedett osztódási aktivitás, pseudopallisad állású tumorsejtekkel övezett tumor-elhalások és érproliferatio látszik. Külön megnevezésű szövettípus az ún. cellularis ependymoma, amelyre jellemző a fokozott sejtsűrűség, anélkül, hogy ez önmagában magasabb grádust jelentene. Immunreaktivitás alapján az ependymomák GFAP-, vimentin-, nesztin-, esetenként S-100- és EMA-pozitívak, az anaplasticus szöveti változatúakban cytokeratin is kimutatható. Ritkán – más neuroectodermalis tumorokhoz hasonlóan – melanintermelés is előfordulhat. Sajátos formái a tanycytás ependymoma (GrII.) és a sokak által GrI. csoportba sorolt myxopapillaris ependymoma. Az utóbbi elsősorban a cauda equina környékén jelentkezik. Lassan nő, de in toto eltávolítása sokszor lehetetlen.
II./2.3.7.: Centrális neurocytoma (GrII)
Supratentorialis, jobbára intraventricularis, CT-n izodenz, gadolinumot halmozó, gyakran meszes tumor. A foramen Monroi elzárásával hydrocephalust okozhat. Intraoperatív vizsgálat kapcsán készített lenyomaton általában látható, hogy a sejtek egyformák, valóban emlékeztetnek az oligodendrogliára, nyúlványaik nincsenek. A monomorph sejtkép mellett eosinophil, sejtmagmentes, fibrillaris neuropil figyelhető meg, helyenként rosetták képzése.
II./2.3.8.: Embrionális daganatok
Közös bennük, hogy differenciálatlan kerek sejtek jelentik alapvető komponensüket. Ezzel az ún. SBTC – small blue cell tumor, azaz kiskéksejtes tumorok közé tartoznak. A szín arra utal, hogy e tumorok HE-festéssel mély basophiliát mutatnak, átnézeti képpel a tumorszövet sötétkék tónusú, mivel a sejtek uralkodó alkotója hyperchrom, megnagyobbodott magjuk, amely a sejttest nagy részét elfoglalja, körülöttük csupán keskeny cytoplasmaszegély van. Emiatt az egész daganat sejtállománya viszonylag monoton sejtalakokból áll, ezt hívják monomorph atypiának. A kiskéksejtes tumorok közé az embrionalis daganatok (neuroblastoma, hepatoblastoma, pancreatoblastoma, nephroblastoma, stb.) mellett a kissejtes tüdőrák, a kis B-sejtes lymphoma és a Ewing-sarcoma tartozik.
II./2.3.8.1.: Neuroblastoma (GrIV)
Nagy malignitású, jellemzően gyermekkori daganat. Intracranialis formája általában supratentorialisan alakul ki, de a kisagyban is előfordul. Emellett kialakulhat extracranialisan is, a perifériás sympathicus idegrendszerben bárhol (mindenekelőtt a paravertebralis sympathicus dúclánc, a mellékvesevelő és a paraganglionok [pl. a Zuckerkandl-féle szerv vidékén). A klasszikus neuroblastomában dominálnak (>50%) a neuroblastok és a neuropil, gyakoriak a neuroblastrosetták. Differenciálatlan (ismert nagysejtes pleomorph változata is), alacsonyan differenciált és differenciált forma különíthető el. Immunhisztokémiailag a tumorszövet diffúzan és erősen NSE-pozitív. Egyéb pozitív markerek: synaptophysin, NFP, gangliozid GD2, chromogranin. A proliferációs index 10-80% között mozoghat.
II./2.3.8.2.: Primitív neuroectodermalis tumorok (PNET, GrIV)
A PNET-koncepció az elsődleges agyállományi daganatok beosztásának ma még legvitatottabb területe. A periférián gyakoribb, de különböző neveken supratentorialisan is leírták: cerebralis medulloblastoma, cerebralis neuroblastoma, supratentorialis kiskéksejtes tumor (SBCT – small blue-cell tumor) stb. A nagyon eltérő irányú kiérés (neuronalis, astrocytaer, ependymalis, izom, melanoticus), ami alapvetően SBCT-környezetben zajlik, gyűjtőfogalommá teszi. Szövettanilag a sejtek anaplasticusak, néha valóban a SBCT jelleg dominál, és differenciálódási jelek nem láthatók. A sejtmagok hyperchromok, a csekély mennyiségű cytoplasma határa elmosódott, az intercellularis mátrix fibrillaris, de alig kivehető. A mitotikus index igen magas (GrIV-nek megfelelő). Nem ritka a vérzés és necrosis, esetenként ún. Homer-Wright-rosetták (egy világosabb, neuropilből álló centrum körül sziromszerűen rendeződő, hyperchrom tumorsejtcsoport) fordulnak elő. A primitív sejtek izomszövetre jellemző antigéneket, máskor glialis antigéneket expresszálhatnak. A supratentorialis PNET cytológiailag legtöbbször szinte elkülöníthetetlen a medulloblastomától.
II./2.3.8.3.: Medulloblastoma (GrIV)
Típusosan a cerebellum malignus, invazív, embrionális tumora, a PNET-csoport legprominensebb képviselője. (A név nem szerencsés, mert „medulloblast” per se nem létezik.) A néha a IV. agykamra fenekéből kiinduló, annak lumenét csaknem teljesen kitöltő, gömbölyded, finoman egyenetlen felszínű daganat (5. makrokép) szövetileg viszonylag éles határú, túlnyomórészt kicsiny, anaplasticus, hyperchrom magvú sejtekből áll, cytoplasmájuk minimális, stroma alig látható. Rosetta jelenléte nem szükséges a diagnózishoz, sok tumorból hiányzik. Általában solid, homogénen halmozó, kombinált chemotherapia nélkül gyorsan halálhoz vezető daganat, mely gyakorta kiterjedten infiltrálja a liquortereket, és távoli metastasisokat is adhat a neuroaxis mentén. Miután a hátsó koponyagödörben a leggyakoribb, az agykamra közelében nő, gyakran okoz hydrocephalust. Az immunhisztokémiailag nagyon változó képet mutat: synaptophysinre, neurofilamentum-fehérjékre, nestinre, vimentinre, esetenként csillag alakú sejtekben a GFAP-re pozitív. A proliferációs index gyakran >20%. A kórszövettani jellegzetességek kórjóslati jelentősége ellentmondásos, az aneuploid DNS-tartalom kedvező jel.
|

Tanulmányozza a makroképet!
|
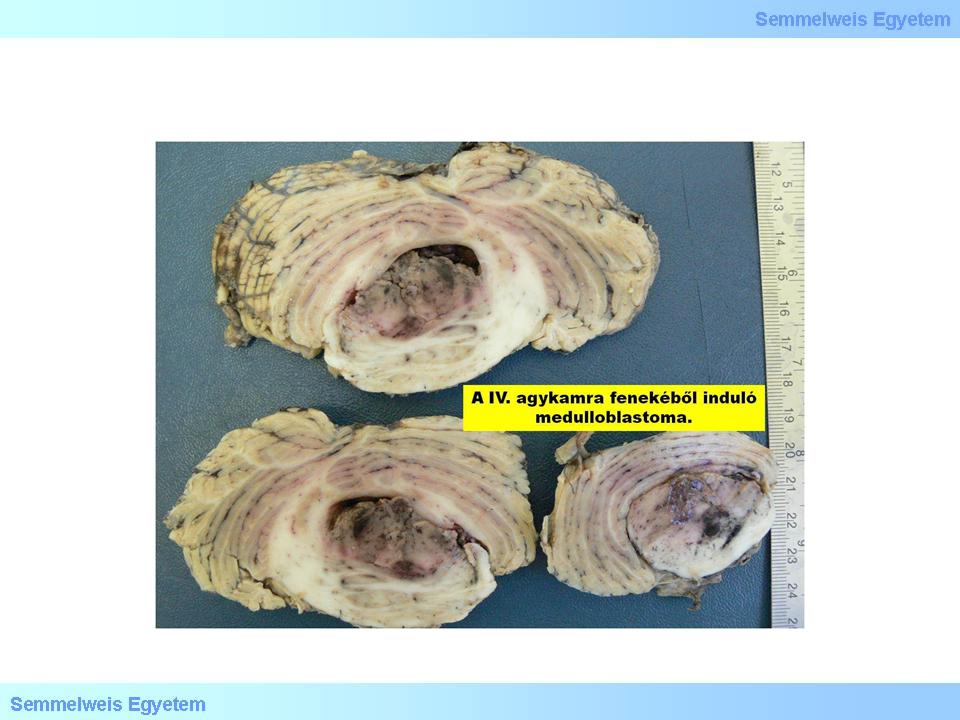
5. makrokép: A medulloblastoma metszlapon tarka képet mutat. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
A legújabb kutatások szerint az eddig egységesnek tekintett PNET-medulloblastoma és a többi kiskéksejtes tumor (SBCT – small blue-cell tumor) (5. mikrokép) genetikailag különböző. Az ezredfordulóig nem volt megbízható módszer ezeknek a daganatoknak az elkülönítésére, még kevésbé a prognózisuk megállapítására. Az DNS-microarray technikával azonban kimutatták (2002), hogy a medulloblastomák expressziós profilja eltér a supratentorialis PNET-étől, és az egyéb anaplasticus malignus gliomákétól. Azt is bizonyították, hogy a medulloblastomák a Sonic Hedgehog (SHH) szabályozó rendszer aktiválása útján a cerebellaris kéreg stratum granulare sejtjeiből származnak. Arra is fény derült, hogy a desmoplasticus medulloblastoma kialakulásában SHH-receptorok (PTCH, GLI) és az N-MYC játszanak szerepet.
|

Tanulmányozza a képet!
|
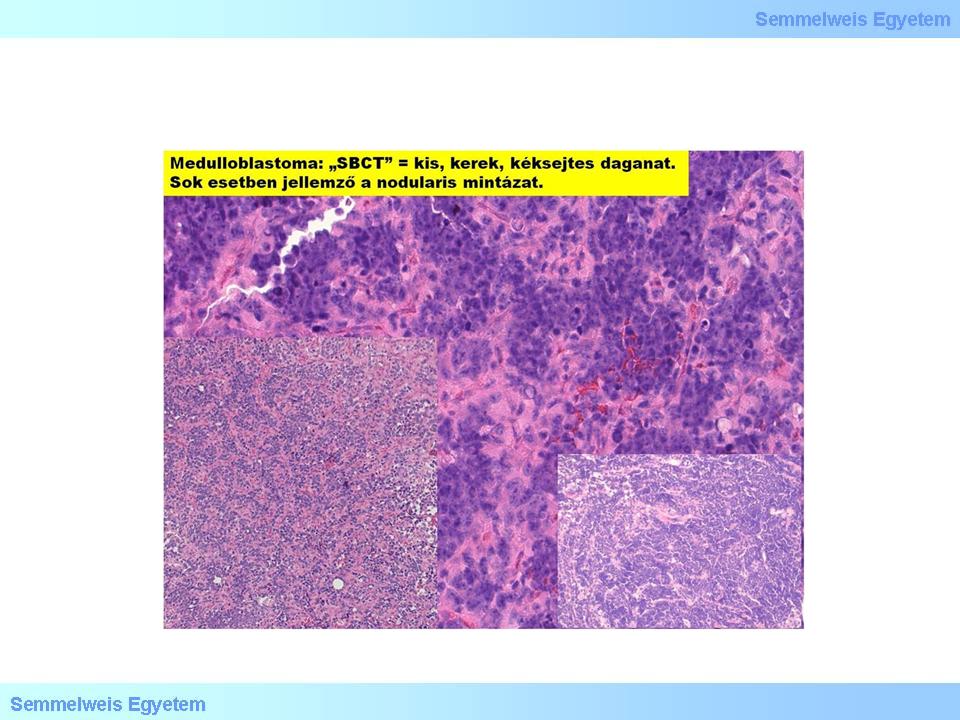
5. mikrokép: A medulloblastoma kiskéksejtes daganat, amely gyakran nodularis mintázatú. (Molnár Péter szívességéből; Debreceni Egyetem OEC, Pathologiai Intézet)
|
|
|