| |
I./2.3.: Arteriosklerose (Gefässverhärtung, Gefässverkalkung) als wichtigster Faktor, der das Herzinfarktrisiko massgeblich erhöht
I./2.3.1.1: Begriffsdefinitionen
Als Arteriosklerose (Sammelbegriff für sämtliche Erkrankungen, die die Gefässwand verhärten) wird die degenerative Veränderung der Gefässwand bezeichnet. Die typischste Erscheinung hierfür ist der arteriosklerotische Plaque. Bei der Plaquebildung handelt es sich um solch eine degenerative Veränderung der Arterien, die die Wand verdickt und verengt; an der betroffenen Stelle sieht man in erster Linie eine bindegewebige-, fettige- und/oder verkalkte Veränderung, die - je nach ihrem Schweregrad - folgende Veränderungen verursacht
|
 |
-
- Veränderung in der Architektur der Gefässwand
-
- Veränderungen der mechanischen Eigenschaften
-
- Verengung des Durchmesser der Arterie – bei einer massenhaften Akkumulation der Plaques.
-
1. die architektonische Veränderungen der Gefässwand bedeutet, dass der Plaque bildende Stoff zuerst die Intima verdickt bzw. deformiert, später dann auch in die Media eindringt, und somit also die einzelnen Schichten verdrängt und das Gefäss in seiner Architektur verändert.
-
2. die Veränderung der mechanischen Eigenschaften bedeutet, dass die Arterienwand an der Stelle, an der sich ein Plaque gebildet hat, seine Elastizität verliert: meist - bei fibrösen und/oder verkalkten Plaques - wird die Wand steif und hart, oder sie wird - bei grossen, atheromatösen Plaques- erst weich, wodurch sich sogar eine Aussackung der Gefässwand bilden kann; dem zufolge kann das Gefäss seiner ursprünglichen Funktion als Windkessel immer weniger entsprechen, bzw. der Belastungen durch die Pulsation des Blutstromes immer weniger standhalten.
-
3. Das Plaque -Wachstum und die Gefässverengung heisst also, dass die sich in der Gefässwand absetzenden Stoffe das Gefässlumen wirklich verengen, und die Durchlässigkeit des Gefässes immer mehr verringern.
Innerhalb der Arteriosklerose wird die sog. Atherosklerose - Erkrankung der elastischen und mittelgrossen muskulären Arterien - bzw. die sog. Arteriolosklerose - Erkrankung der kleinen muskulären Arterien und Arteriolen - voneinander unterschieden. Die Mönckeberg –Mediasklerose stellt eine eigenständige und seltene Form der Gefässverhärtung dar. All diese Gefässveränderungen kommen bei bestimmten Stoffwechselerkrankungen -v.A. bei einem Diabetes mellitus – besonders häufig und in einer besonderen Variation vor. Bei den Komplikationen der Arteriosklerose sind die lokalen Aussackungen der Gefässe (sog. Aneurysmen) bzw. die Aufspaltung der Gefässwandschichten (Gefässdissektion) zu erwähnen.
I./2.3.1.2.: Schwierigkeiten bei der Nomenklatur (KV_I_2_1.Verweis)
I./2.3.2.: Epidemiologische Bedeutung
In den Industrienationen stellt die Arteriosklerose bei 50 % der Bevölkerung die Todesursache dar (sog. Zivilisationserkrankung). Die Arteriosklerose ist nicht, wie zu erster gedacht, eine Erkrankung des höheren Lebensalters, sondern sie beginnt sich schon in jungen Jahren zu bilden. Erste Berichte darüber findet man in der amerikanischen Literatur der 50er Jahre, als zu Zeiten des Koreanischen Krieges junge gefallene Soldaten seziert worden, und dies hinsichtlich untersucht worden sind.
I./2.3.3.: Fettstoffwechsel
Bei der Bildung der Arteriosklerose spielt der Fettstoffwechsel (Lipidmetabolismus) eine massgebliche Rolle. Die im Körper zu findenden wichtigsten Lipide sind in der Tabelle 1 zu sehen.
|

Beurteilen Sie die Tabelle
|
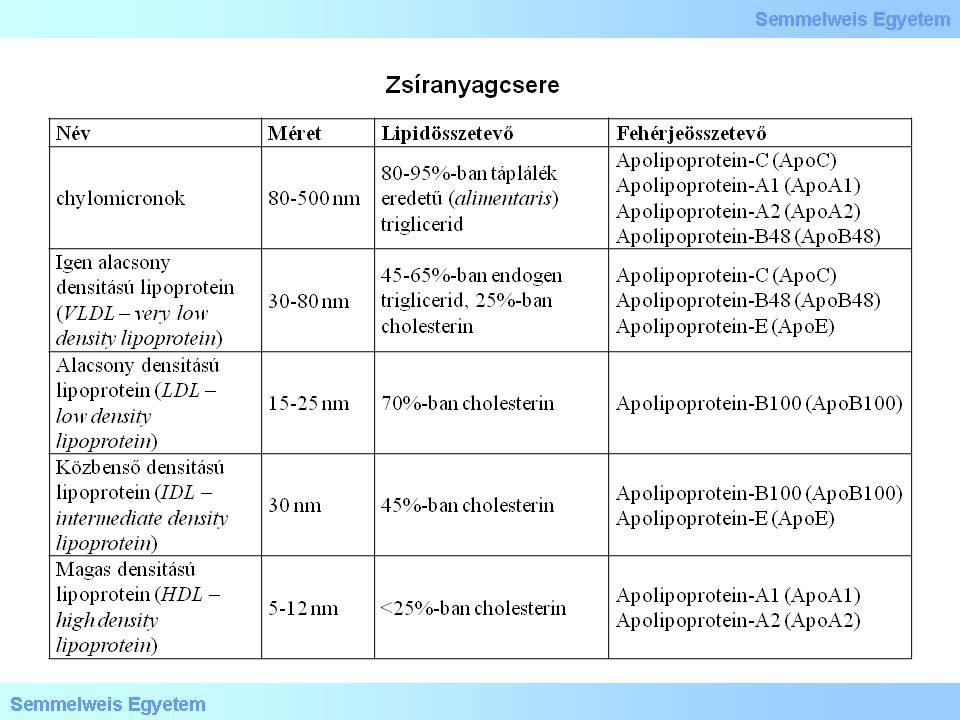
Tabelle 1: Fettstoffwechsel
|
Der sog. exogene Weg des Lipidtransportes verläuft vom Darm bis zur Leber; die so transportierten Fette sind Chylomikrone. Der sog. endogene Weg des Lipidtransportes verläuft in die andere Richtung, die Fette werden aus der Leber in Form von VLDL in das Gefässnetz transportiert, gelangen so schließlich bis an die peripheren Gewebe (extrahepatisch), und werde dort mit Hilfe einer Lipoprotein -Lipase zu IDL bzw. LDL umgewandelt. Beim exogenen Transport gelangen die Fette von den peripheren Geweben in Form von HDL, IDL, bzw. LDL bis zur Leber.
I./2.3.4.: Zellelemente der Arteriosklerose
Die wichtigsten Zellelemente, die an der Gefässverhärtung teilnehmen, sind die Endothelzellen, die Monozyten/Makrophagen und die glatte Muskelzellen.
I./2.3.4.1.: Endothelzellen
|
 |
Die wichtigste Aufgabe des Endothels besteht darin, dass die innere Oberfläche der Gefässe eine Schicht bildet, an der keinerlei Stoffe hängenbleiben bzw. sich keine Thromben bilden können. Ferner wird vom Endothel die Permeabilität der Gefässwand, und die Bildung fibrinolytischer bzw. gerinnungsaktivierender Stoffe, die Leukozyten- und Thrombozyten Anheftungen (sog. homing) und die Oxidation der Fette geregelt. Das Endothel bildet ausserdem sog. chemotaktische und extrazelluläre Matrix -Komponenten, und sorgt dafür, dass die glatte Muskelzellschicht der Gefässe proliferiert und eine Migration möglich macht; das Endothel unterhält auch bestimmte Stoffwechselfunktion (z.B. die Oxidation von LDL), und bildet vasoaktive Stoffe (NO, PGI2, Endothelin, Angiotensin II, TXA2), durch die die Elastizität der Gefässwand aufrechterhalten bleibt; das Endothel bildet auch die Basalmembran, wodurch es ebenfalls zur Elastizität der Gefässe beiträgt, und es nimmt auch an Entzündungsreaktionen bzw. an immunologischen Reaktionen teil.
I./2.3.4.2.: Monozyten/Makrophagen
|
 |
Es handelt sich hier um eines der wichtigsten Zellelemente der Atherogenese. Die Monozyten/Makrophagen sind für die Oxidation und die extrazelluläre Aufnahme von Fetten zuständig, und bilden auch Schaumzellen; Makrophagen nehmen also am Fettstoffwechsel teilen. Sie bilden extrem viele Zytokine, wie z.B. Wachstumsfaktoren (GM-CSF, M-CSF, HB-EGF, IGF-I, VEGF, bFGF, TGF alpha, PDGF, IL- 2), Wachstumshemmer (IL-1, TNFalpha, TGFbeta), und chemotaktische Stoffe (MCP-1, oxLDL). Sie nehmen an der Immunabwehr als Antigen präsentierende Zellen teil und aktivieren somit T- Zellen, bzw. dienen als ’scavenger’ (Strassenkehrer), "räumen schädliche Stoffe aus dem Weg" und eliminieren diese.
I./2.3.4.3.: Glatte Muskelzellen
Es gibt zwei verschiedene Phänotypen von glatten Muskelzellen, den
-
a) kontraktilen und den
-
b) synthetischen Typ.
Der kontraktile Phänotyp ist der allgemeinen bekannte Zelltyp der glatten Muskelzellen, der reich an Myofilamente ist, sich also zusammen ziehen kann. Die Fettaufnahme und Abgabe dieser Zellen ist ausgeglichen, es gibt keine Fettakkumulation, und aus dieser Art von Zellen können sich auch keine Schaumzellen bilden. Der synthetische Phänotyp der glatten Muskelzellen ist im Gegensatz dazu reich an rauhem endoplasmatischen Retikulum (RER), bildet auf Stimuli von Zytokinen hin (PDGF, beta FGF, TGF beta) Elemente der extrazellulären Matrix und expressiert LDL- bzw. "Strassenkehrer"-Rezeptoren; Letztere bringen die Zellen dazu, dass die Fettaufnahme die Fettabgabe überflügelt; hier können sich also die Fette akkumulieren, und die Zellwandelemente können zu Schaumzellen umgeändert werden. Die glatten Muskelzellen sind fähig, aus der Media in die Intima abzuwandern.
I./2.3.5.: Zellelemente der Atherogenese
|
 |
Die Pathogenese der Arteriosklerose ist noch nicht ganz geklärt,und kann bisher nur auf Theorien gestützt werden. Der Grund hierfür ist, dass sich die Bildung der Arteriosklerose nur schwer modellieren lässt; die Erkrankung ist multifaktoriell und bildet sich über Jahre, oder sogar Jahrzehnte, aus. Den neuesten Stand der Forschung zeigt das sogenannte "Antwort auf einen Reiz " (`response to injury`) - Modell, das auch Elemente anderer, schon akzeptierter Erklärungsversuche beinhaltet, die so zusammen interpretiert werden können: das "Fettstoffwechsel "- Modell erklärt die Bildung der Arteriosklerose mit einem abnormalen Fettstoffwechsel; das "thrombogene "- Modell ist eines der ältesten Theorien, das "Entzündungs- bzw. Infektions-, und Autoimmun-" Modell führt die Bildung der Arteriosklerose auf das Vorhandensein einer Entzündungsreaktion zurück.
I./2.3.5.1.: Die "Antwort auf einen Reiz" ("response to injury) Theorie
Diese Theorie ist darauf aufgebaut, dass es sich bei der Atherogenese um die selbe stereotype Antwort der Gefässwand auf jegliche störende Faktoren handelt. Eine zentrale Rolle spielt dabei die fokale Aktivierung (Stimulation) des Endothels, dessen Reaktivität und Stoffwechsel, als erster Schritt bei der Atherogenese, komplett umgestellt wird.
I./2.3.5.1.1.: Gefässwand schädigende Faktoren - Wirkung, Art, Hintergrund
|
 |
Die Gefässwand schädigenden Faktoren können sehr vielseitig sein; es handelt sich hierbei - unter anderem- um zellbiologisch, geometrisch, mikroanatomisch (sog.’progression-prone’ vs.’progression-resistant’ Lokalisation) mechanisch-hämodynamisch und chemisch bedingte Faktoren, die auch das Mikroklima der Zellen beeinflussen können; alle diese Faktoren können auch in verschiedensten Kombinationen zusammen vorkommen.
Der zuletzt erforschte ubiquitäre Schädigungsmechanismus ist ein chemisch- zellbiologischer, der sog. Häm-gebundene zytotoxische Mechanismus. Hierbei kommt es durch eine Oxidierung zu einer lokalen Endothelschädigung. Das aus den roten Blutkörperchen austretende Hämoglobin wird im Blutplasma oxidierte, und es wird Feri- oder Methämoglobin gebildet, wodurch das Häm-Molekül seinen Protein Schutzmantel verliert. Das freiliegende Häm-Molekül bzw. Häm-Fe ist für die Endothelzellen toxisch – da beide freier Radikale bilden - und katalysiert so eine Reaktion, die die durch polymorphkernige Granulozyten (PMN) gebildete Zellschädigung verstärken (die durch oxidative Stoffe verursachte zellgebundene Zytotoxizität wird somit verstärkt). Die direkt am freiliegenden Häm lokalisierten Endothelzellen sind bei diesem Vorgang besonders die gefährdet.
|
 |
Der zellschädigende Mechanismus beruht darauf, dass das ausgesprochen hydrophobe Häm-Molekül ungebremst durch jede Zellmembran hindurch gelangen kann, das heißt also, dass es ohne Probleme spontan in die Endothelzellen penetrierenden kann. Das frei werdende Häm-Fe katalysiert so die Oxidation bestimmter Zellelemente und im Endothel befindlicher LDL- Moleküle. Das so gebildete oxLDL wirkt direkt zytotoxisch auf die Endothelzellen, verursacht also oxidative Schäden. Der Grund dafür, weshalb dieser aktivierte Mechanismus nicht grenzenlos fortgesetzt werden kann, ist der, dass auch protektive Proteine eingeschaltet werden. Eines dieser Proteine ist
a) Hämopexin, ein Serumprotein, das zur Häm-Bindung fähig ist und in einer extrem hohen Konzentration in Endothelzellen vorkommt. Die selbe Wirkung zeigen
b) Haptoglobin und Albumin, die ebenfalls Häm bindende Plasmaproteine darstellen. Einen spezifischen gemeinsamen intrazellulären Effekt zeigen das
c) Häm-Oxigenase-1 (HO-1) genannte Element und das Ferritin: HO-1 spaltet den Protoporphyrin-Ring des Häm-Moleküls, und setzt dessen aktives Eisendepot frei, das dann an das antioxidativ wirkende Ferritin gebunden wird.
|
 |
Die Gefässverkalkungen wird ausserdem von der Konstitution des betroffenen Organismus beeinflusst. Hierunter versteht man die genetische Konstitution des Betroffenen,sowie die chemische Zusammensetzung des Blutes. Letzteres wird vor allem durch solche Eigenschaften, wie z.B. dem pH-Wert des Blutes oder dessen Fettgehalt bestimmt. Die genetische Konstitution des Betroffenen beeinflusst in jeder Hinsicht den Krankheitsverlauf- nicht nur den der Arteriosklerose- durch die Dynamik der einzelnen Schritte bei der Pathogenese (hier: Aktivation der Faktoren, Transportmoleküle, Enzyme, usw.), wodurch das Ausmass bzw. die Auswirkungen einer Erkrankung beschleunigt, verlangsamt, und auch komplett verändert werden können.
Da jeder einzelne Pathomechanismus von unzählig vielen Faktoren beeinflusst wird – so z.B. von den darin teilnehmenden Proteinen, die von einer genetisch kodierten Aminosäuresequenz bestimmt werden, und unter einem bestimmten Mikromilieu einen spezifischen dreidimensionalen Aufbau zeigen, usw.- und aus unzählig vielen Schritten besteht, können bei jedem Individuum unendlich viele Variationsmöglichkeiten eines Erkrankungsverlaufes vorkommen.
|
 |
So ist auch das Phänomen zu erklären, dass bei einigen Individuen auch ohne ein definitiv vorhandenes Syndrom eine relativ frühe Arteriosklerose zu beobachten ist (im Volksmund: jemand "anfällig für Arteriosklerose" ist), Andere wiederum sogar in höherem Alter ohne massgebliche arteriosklerotische Veränderungen leben; zusammenfassend kann man also sagen, dass die Anfälligkeit für Arteriosklerose von bestimmten äusseren Faktoren (soziale Faktoren, Ernährung, Lebensstil, usw.) genauso abhängt, wie von der Genetik (vergleiche auch die sich ändernden epidemiologischen Werte bei Einwanderern). Ein gut funktionierender Organismus kann bestimmte zellschädigende Faktoren ohne weiteres ausgleichen; ein biologisch labiler Organismus kann schon bei relativ harmlosen Schädigungen aus dem Gleichgewicht gebracht werden, und muss somit auch anders behandelt werden (im ersten Falle kann man ’essen was man will’, im zweiten Fall muss eine cholesterinarme Diät eingehalten werden).
I./2.3.5.1.2.: Hämodynamische Voraussetzung der Plaquebildung
Bei Gefässabzweigungen (sog.flow divers) wird der laminäre Blutstrom gestört, in zwei geteilt, und bildet direkt nach seiner Aufzweigung einen Strudel. Dies hat die Minderung der Scherkräfte, und auch das Verlangsamen des Stroms der Blutkörperchen zur Folge, wodurch die atherogen wirkenden Stoffe längere Zeit an der Membranwand verweilen können. Fakt ist, dass bei Gefässaufzweigungen die Atherosklerose immer stärker vorhanden ist.
I./2.3.5.1.3.: Theorie der Plaquebildung
Nach einem schädigenden Einfluss am Endothel wird dessen Fettstoffwechsel verändert (oxLDL Produktion!), bzw. aktivierte Moleküle gebildet (chemotaktische Stoffe, mitogene Stoffe, Wachstumsregulatoren, NO, Adhäsionsmolekülen, thrombogene Faktoren). Die Zellantwort hierauf ist die Adhäsion verschiedenster Zellelemente - Leukozyten, Thrombozyten, Monozyten, T-Lymphozyten-an die aktivierten Endothelzellen (homing), die durch intrazelluläre Spalten in die Intima vordringen, sich dort vermehren, und schliesslich selber Migrations- Zellteilungs- bzw. Wachstumsfaktoren bilden, und so immer mehr biologisch aktive Zellen anziehen.
|
 |
Bei solch einer Stimulation werden die Endothelzellen ausserdem permeabler, was heisst, dass Fette und Zellelemente in die Intima eingeschwemmt werden können (Insudation). Ferner gelangen auch weitere Zellen aus der Gegenrichtung (durch die Membrana elastica interna der Media) in das Endothel, und durch die Zytokin -Stimuli beginnen auch die glatten Muskelzellen der Intima zu proliferieren. Die so vermehrte Anzahl der glatten Muskelzellen im Endothel ist massgeblich für die Plaquebildung, weil aus einem kontraktilen Phänotyp ein synthetischer Phänotyp geworden ist, der extrazelluläre Matrixkomponenten (vor allem Kollagen) bildet.
Parallel zum oben beschriebenen Vorgang werden die ins Endothel eingeschwämmten Monozyten zu Makrophagen, die zusammen mit den synthetisch gebildeten glatten Muskelzellen beginnen, sich die extrazellulären Lipide einzuverleiben, wodurch eine massenhafte Schaumzellbildung beginnt. Die Schaumzellen gehen zum Teil an der zu intensiven Fettaufnahme zugrunde, und werden so zu extrazellulären Fettpfützen, die verschmelzen und durch bioaktive Zytokine wieder Zellen in die direkten Umgebung locken. Dieser Vorgang wächst sich zu einer Lavine aus, die schliesslich zur Bildung von atheromatösen Plaques führt.
I./2.3.5.2.: Das Fettstoffwechsel Modell
Man hält die Ablagerung von Fetten (Insudation) in den Schichten der Gefässwand für einen der wichtigsten Faktoren bei der Bildung der Arteriosklerose. Die Bedeutung dieses Vorganges wird durch zahlreiche epidemiologische und kliniko - pathologische Beobachtungen unterstrichen:
|
 |
a) Zusammenhang zwischen dem Körpergewicht und der Arteriosklerose;
b) das Vorhandensein eines erhöhten Serum LDL- und Serum V LDL -Spiegels bzw. ein niedriger Serum HDL -Spiegel hat ein höheres Plaquebildungsrisiko zur Folge;
c) die Wirkung atherogener Diäten bei Tierversuchen;
d) familiäre Fettstoffwechselstörungen und deren Wirkung auf die Gefässe (Verringerung der Zahl der Rezeptoren, Genfehler, familiäre Hyperlipidämie).
Diese Theorie beruht auf die Tatsache, dass die in die Intima eindringenden Fette von den ebenfalls angeschwämmten Monozyten/Makrophagen aufgefressen werden, ihre spezifischen LDL -Rezeptoren allerdings mit der Zeit besetzt werden und die unspezifischen, sog. "scavenger" (Strassenkehrer) Rezeptoren mit eingeschaltet werden, die eine ungebremste Fettaufnahme ermöglichen. Da die Fettaufnahme so aber höher ist, als die Menge, die von der Zelle aufgearbeitet werden kann, wird der Überluss in Form von Fetttröpfchen gespeichert; so bilden sich die Schaumzellen. Das Produkt des pathologischen Fettstoffwechsels ist das oxLDL, dass durch eine Oxidierung an der Endothelstimulation teilnimmt. Letzteres führt wiederum zur Bildung von Adhäsionsmolekülen, die erneut Monozyten anlocken.
I./2.3.5.3.: Das thrombogene Modell
Hier wird die Ausbildung einer Thrombose an der Gefässwand (die nicht unbedingt okklusiv ist) als ausschlaggebender pathogenetischer Faktor angesehen, die weitere im Blutkreislauf befindliche Zellelemente an die Stelle anlockt, diese organisiert, und so zu einem Plaque wird. Dem aktuellen Stand der Forschung folgend wird die Thrombose heutzutage als Folge, und nicht alles Auslöser der Atherogenese angesehen.
I./2.3.5.4.: Das Entzündungs- Infektions- Autoimmun- Modell
|
 |
Es gibt viele Fälle, bei denen die sich bildende Gefässverhärtungen nicht mit den konventionellen Risikofaktoren im Einklang stehen. Deshalb wurde in letzter Zeit intensiv nach unkonventionellen oder alternativen Risikofaktoren der Arteriosklerosebildung geforscht, was die Aufmerksamkeit auf mehr oder weniger stark vorhandene Entzündungsinfiltrate im befallenen Gefässwandabschnitt gerichtet hat. Danach wurde eine latent vorhandene, nicht manifestierte Entzündung vorausgesetzt, bzw. im Rahmen einer Autoimmunantwort an eine sterile Entzündung als atherogenetischer Auslöser gedacht. Diese Theorie wurde ausserdem von der Tatsache unterstrichen, dass an der Stelle, wo arterio-sklerotische Plaques lokalisiert sind, immer eine leichte lymphozytäre Infiltration zu sehen ist.
Die Forschung in dieser Richtung war insofern erfolgreich, als dass an den befallenen Gefsswandabschnitten wirklich in mehreren Fällen das Vorhandensein verschiedener Erreger nachgewiesen werden konnte. Es konnte allerdings nicht geklärt werden, ob diese Erreger wirklich einen pathologischen Vorgang indizieren, bzw. den Erkrankungsablauf erschweren, oder nur, ohne zum Geschehen beizutragen, dort lokalisiert sind (sog. innocent bystander- Hypothese). Die zur Eradikation der Erreger eingeführte Antibiosetherapie, die zur Heilung der sklerotischen Gefässveränderungen hätte führen sollen, hat aber keinen eindeutigen Erfolg gebracht; der Grund hierfür liegt wohl in der multifaktoriellen Genese der Arteriosklerose verborgen.
|
 |
Dass am gründlichsten erforschte Bakterium, dass für die Bildung der Arteriosklerose verantwortlich gemacht wird, ist Chlamydia pneumoniae (Jahr der Erstbeschreibung: 1989), ein hoch spezialisiertes, Gram -negatives Bakterium, das obligat intrazellulär vorkommt, und keinen eigenen Energiebildungsmechanismus besitzt. Seine intrazelluläre Lokalisation macht das Bakterium für ein menschliches Immunsystem unsichtbar, und bildet so - ähnlich dem bekanntesten Mitglied der Chlamydia -Familie, dem C. Trachomatis (Jahr der Erstbeschreibung: 1907) - eine latente chronische Entzündung ohne akute Phasen, die zur Bindegewebsvermehrung und zu einer narbenbildenden Entzündung (s.: fibröse Plaques) beiträgt. Dieses Bakterium kann ausser in den Gefässen noch typischer Weise in den Luftwegen lokalisiert sein.
Weitere Erreger, die wegen der Pathogenese der Arteriosklerose untersucht worden sind, ist der Helicobacter pylori (seine Rolle in der Bildung der Arteriosklerose ist nie für wirklich wahrscheinlich erachtet worden), das CMV, das Herpes simplex Virus, Mycoplasma pneumoniae, und das Hepatitis-A Virus. Fast alle diese Mikroben sind ebenfalls intrazellulär pathogene Erreger. Ferner haben alle diese Erreger eine proinflammatorische Wirkung auf das eigentlich antiinflammatorische, und antikoagulierend bzw.antiatherogen wirkende Mikromilieu der Gefässwand, und führt dazu, dass (durch das Auslösen von humoralen und zellgebundenen Reaktionen) das Endothel koagulationsfähig und damit proatherogen wird.
Im Rahmen der Erforschung der Hintergründe der Atherogenese ist auch der Gedanke aufgekommen, ob nicht eine autoimmune Reaktion als Auslöser in Frage kommen könnte. Nach der Entdeckung sog. Anti- Cholesterin Antikörper (ACHA) und einem erhöhten Serumspiegel dieser Antikörper bei Patienten mit Gefässverhärtungen, konnte man darauf schliessen, dass die cholesterinhaltigen sklerotischen Plaqueablagerungen eines Atheroms wegen ihrer langen Verweildauer früher oder später eine Autoimmunantwort des Organismus auslösen, was zur Verschlechterung bzw. Progression der Erkrankung führen kann.
I./2.3.6.: Risikofaktoren
Es lässt sich also aus dem bisher Besprochenen folgendes ableiten: die Risikofaktoren für eine Gefäßverhärtung können in eine
-
- herkömmliche (konventionelle) und
-
- eine „neue”, unkonventionelle (alternative) Gruppe eingeteilt werden.
Die wichtigsten herkömmlichen (konventionellen) Risikofaktoren sind:
|
 |
-
- Hyperlipidämie, Hypercholesterinämie
-
- Diabetes mellitus
-
- Rauchen
-
- Übergewicht (Obesitas)
-
- erhöhter Bluthochdruck (morbus hypertonicus)
-
- männliches Geschlecht, höheres Alter
-
- Hyperhomozysteinämie
-
- vererbte, genetische Faktoren.
Die "neuen", unkonventionellen (alternativen) Risikofaktoren, die ihre Wirkung durch eine Entzündung der Gefässwand erreichen:
-
- durch Erreger hervorgerufene Gefässinfektion
-
- Immunreaktionen, Autoimmunität.
I./2.3.7.: Morphologie der Gefässverhärtung
I./2.3.7.1.: Lokalisation
Häufigste anatomische Position einer schweren Arteriosklerose sind - mit sinkender Wahrscheinlichkeit:
-
1) infrarenaler Abschnitt der Bauchaorta / Aa. iliacae
-
2) proximale Strecken der Herzkranzgefäße
-
3) absteigende Aorta/Arteria femoralis/Arteria poplitea
-
4) A. carotis interna
-
5) Arterien des Gehirns: A. vertebralis; A. basilaris; A. cerebri media.
I./2.3.7.2.: Erscheinungsformen der Gefässverhärtung (AHA-Einteilung)
|
 |
Die AHA (American heart association) teilt die arteriosklerotischen Veränderungen in eine frühe, und in eine späte Gruppe ein, bzw. unterscheidet noch eine Übergangsform, das Präatherom. Die frühen Gefäßveränderungen bilden sich in den ersten 2-3 Lebensjahrzehnten (1A), sind noch reversibel, und verursachen keine klinischen Symptome. Die späten Läsionen bilden sich im Gegensatz dazu in einer späteren Periode des Lebens, verursachen Symptome, und bedeuten einen irreversiblen Umbau der Gefäße.
I./2.3.7.2.1.: Frühe arteriosklerotische Veränderungen – AHA I
Es handelt sich hierbei vor allem um sog. submikroskopische Veränderungen, die oft nicht einmal mit dem Lichtmikroskop zu sehen sind. Intrazelluläre Fettansammlungen (Fetttröpfchen, lipid-droplets) können in einigen wenigen Zellen detektiert werden, die sich aber noch nicht zu größeren Zellhaufen zusammentun. An den sog. progression-prone Gefässabschnitten (z.B. bei Gefässaufzweigungen), an denen sich später die sog. Spätläsionen festsetzen, und komplexe Plaques bilden, können sogar schon in der Kindheit solche Veränderungen gesehen werden.
I./2.3.7.2.2.: Frühe arteriosklerotische Veränderungen – AHA II
Bei diesen Veränderungen handelt es sich immer noch um intrazelluläre Fettansammlungen, die Zellen bilden allerdings schon Zellhaufen (Histiozyten -Ansammlungen). Diese Erscheinung ist auch schon makroskopisch, in Form von sog. fettigen Streifen (fatty streak), zu sehen (1. Makrofoto).
|

Beurteilen Sie das Bild!
|
1. Makrofoto: Fettige Streifen als Zeichen einer frühen, geringgradigen arteriosklerotischen Veränderung an einem Kranzgefäß. Diese Form von Plaque verursacht keine signifikante Stenose (aus der Sammlung von Tibor Glasz- Bildarchiv des II. Pathologischen Institutes der Semmelweis Universität, Budapest).
|
I./2.3.7.2.3.: Mittelmässige (intermediäre) arteriosklerotische Veränderungen – AHA III
Diese als intermediär bezeichnete Gruppe beinhaltet bloss eine Art der Veränderung, das sog. Präatherom. Es entstehen hier sowohl intra- als auch extrazelluläre Lipidansammlungen: sog. Fettpfützen (lipid-pools) sind hierbei zu sehen. Diese Veränderung stellt sowohl makroskopisch (intra- und extrazelluläre Fettansammlungen), als auch chemisch (Zusammensetzung der Fettsäuren) eine Zwischenstufe zwischen der frühen und der späteren arteriosklerotischen Veränderung dar.
I./2.3.7.2.4.: Späte arteriosklerotische Veränderungen – AHA IV
Diese Veränderung ist das sog. Atherom (athera/gr./- Brei), die späte Weiterentwickung eines Plaque in eine instabile Richtung. Das Atherom setzt sich folgender Massen zusammen: im Inneren ist ein atheromatöser Fettkern zu sehen (sog. lipid core), der oft von ausgelösten schleifsteinförmigen Cholesterinkristallen umgeben wird, und auf dem eine sog. fibröse Kappe sitzt, die sich Richtung Gefässlumen vorwölbt (sog. fibrous cap); diese Ausstülpung wird von Endothel bedeckt. Das Verhältnis der einzelnen Elemente zueinander bestimmt die Stabilität eines Plaque (s. dort). In der fibrösen Kappe kann sich eine Kalkablagerung bilden. Der atheromatöse Fettkern kann sich dermassen erweitern, dass er u.U. sogar die gesamte Breite der Media durchzieht, wodurch die Gefässwand geschwächt wird; wegen der mechanischen Dauerbelastung, die vom Druck des Blutes stammt, kommt es an der Gefässwand früher oder später zur Bildung einer sack- oder spindelartigen Aussackung, einem sog. Aneurysma.
I./2.3.7.2.5.: Späte arteriosklerotische Veränderungen – AHA V
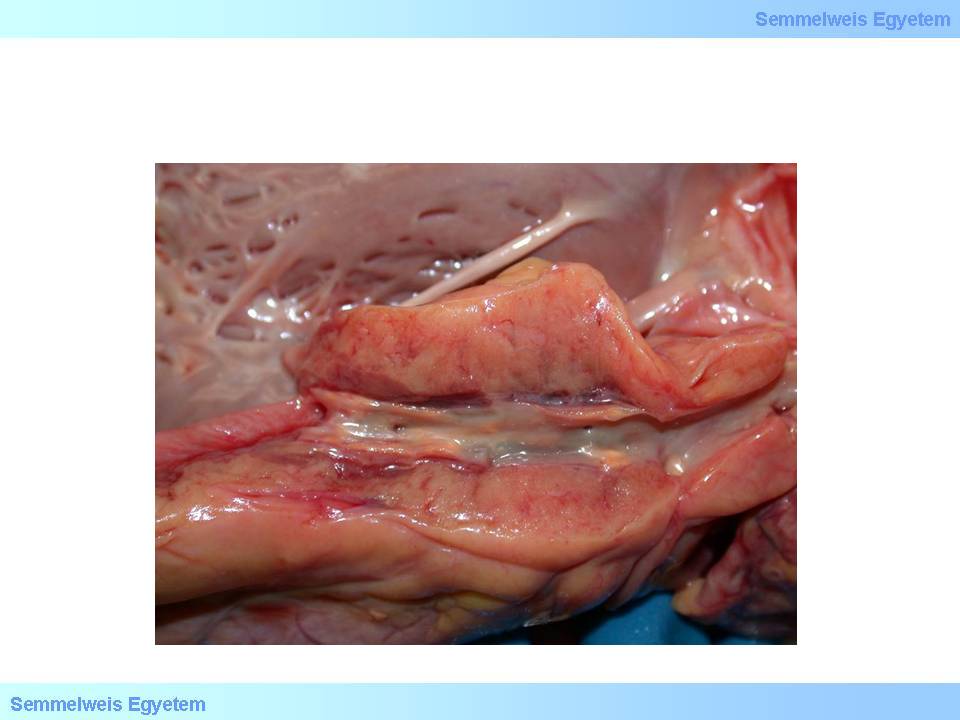
Hierbei handelt es sich um das sog. Fibroatherom (fibröses Plaque), dass eine späte arteriosklerotische Veränderung in eine stabile Richtung darstellt. Diese Veränderung hat im Gegensatz zu einem Atherom einen um einiges kleineren (verschwindend wenig) Fettkern, und die Läsion wird hauptsächlich von der fibrösen Kappe gebildet. Der Fettkern kann auch gänzlich fehlen; in solchen Fällen besteht die Läsion nur aus narbigem Bindegewebe. Die Ablagerungen von Kalk in solch einer Läsion (2. Makrofoto) ist ein Zeichen für bradytrope Verhältnisse.
|

Beurteilen Sie das Bild!
|
2.Makrofoto: Verkalkte Plaques in einer Koronararterie. Kalk kann als degeneratives Zeichen in jedem Stadium der Plaquebildung vorhanden sein (Bildarchiv des II. Pathologischen Institutes der Semmelweis Universität, Budapest).
|
I./2.3.7.2.6.: Späte arteriosklerotische Veränderungen – AHA VI
Hierbei handelt es sich um Plaques mit Komplikationen, die typischerweise in instabilen Plaques gebildet werden. Es gibt zwei Formen der Komplikationen: die Einblutung der Plaques und deren Thrombotisierung.
-
1. Bei einer Plaque Einblutung springt die fibröse Kappe an einer Stelle, wodurch das Blut bis ans Innere des Plaques gelangen kann, so also den atheromatösen Fettkernen auch mit einbezieht. Das Blut, das wie ein Strahl im Fettkern landet, bläst den Kern ballonartig auf und verschließt das Lumen des Plaques. Der selbe Mechanismus ist auch bei der Aufspaltung einer Gefässwand (Dissektion) zu sehen.
-
2. Bei einer Plaque -Thrombose wird die gesamte fibrinöse Kappe mit dem Blutstrom mitgerissen (sog. usuriertes Plaques); der thrombogene Fettkern gelangt so ins Gefässlumen, kommt in direkten Kontakt mit dem Blut, aktiviert so den extrinsic Weg der Blutgerinnung, und sorgt innerhalb kürzester Zeit dafür, dass sich ein Blutgerinnsel bildet.
I./2.3.7.2.7.: A plakk stabilitása
|
 |
Unter der Stabilität eines Plaques versteht man die prädiktive, morphologische bzw. klinisch- biologische Verhaltensweise einer Gefässverhärtung. Eine stabile Veränderung nennt man also die Art vor Gefässverengung, die weder mechanisch noch strukturell, also vom klinisch- biologischen Verhalten her keinerlei Hinweise auf eine mögliche, plötzliche Veränderung gibt: das heißt, dass dieser Plaque stabil ist. Typische Vertreter dieser Gruppe sind die fibrösen Plaques, bzw. Fibroatherome. Ein instabiler Plaque zeigt mechanisch, strukturell, und somit also auch vom klinischen Verhalten her eine schlecht prognostisierbare Gefäßwandverdickung, bei der man plötzliche Veränderungen (sog. Plaque- Komplikationen) und/oder strukturelle Veränderungen nicht ausschließen kann : das bedeutet, dass die Verhältnisse instabil, nicht voraussehbar sind. Ein typischer Vertreter dieser Gruppe ist das Fettkern haltige Atherom.
|
 |
Unter dem klinisch- biologischen Verhalten eines Plaque versteht man die Art und Weise, wie das betroffene Gefäss die Blutstromverhältnisse verändert: verursacht ein Plaque unerwartete Schwankungen - vor allem eine Senkung der Blutmenge -, nennen wir es instabil; verursacht ein Plaque ganz sicher keine hämodynamischen Veränderungen, so ist diese Veränderung stabil. Das klinisch- biologische Verhalten eines Plaque, und dessen hämodynamische Wirkung hängt stark vom morphologischen Aufbau, und dem damit verbundenen mechanischen Widerstand ab.
Die Gefahr bei einem instabilen Plaques besteht darin, dass er eben wegen seiner mechanischen Instabilität - von den aktuellen hämodynamischen Verhältnissen abhängig- zu plötzlichen Strukturänderungen fähig ist; ein instabiler Plaque ist so von seinem morphologischen Aufbau her fähig, das Gefässlumen massgeblich zu verengen; eben dies kann eine so kritische Situation auslösen - falls das Lumen innerhalb kürzester Zeit verstopft wird -,dass es im jeweiligen Versorgungsgebiet zu ischämischen Symptomen (z.B. plötzliche Schmerzen - s. Angina pectoris, Angina abdominalis, Claudicatio intermittens, usw.), oder sogar zum definitiven Infarkt kommt.
Die mechanische Stabilität eines Plaque ist also mit der klinischen Stabilität direkt im Einklang, was heisst, dass wenn ein Plaque mechanisch stabil ist, dies auch für das klinische Verhalten gilt, und umgekehrt. Der Aufbau des Plaques lässt also unmittelbar auf die Aussichten des Patienten schließen.
|
 |
Die Bildung eines Plaque kann also - auf die Stabilität bezogenen- so zusammengefasst werden: die wichtigsten Frühformen
(1) die Fettstreifen ("fatty streak"), die als Zwischenstufe angesehen werden.
(2) das Präatherom, das sich in zwei Richtungen weiter bilden kann:
(3-a) in ein instabiles Plaque (Atherom), dass ausserdem zu
(4) Komplikationen führen kann (Plaque Einblutungen und -Thrombosen), bzw.
(3-b) oder es kommt zur Ausbildung eines stabilen Plaques (fibrös- verkalktes Plaques, Fibroatherom).
Risikofaktoren eines instabilen Plaques:
1) mechanischer Aufbau des Plaques;
2) Entzündungsinfiltrate in der fibrösen Kappe;
3)Verkalkung der fibrösen Kappe.
1. Aus dem eben erörterten lässt sich also schlussfolgern, dass aus mechanischer Sicht das Dominieren solcher Elemente des Plaques, die "weich" sind (vor allem der Fettkern des Atheroms), das Plaques in stabile machen; umgekehrt gilt dasselbe: je höher der Anteil des Plaques an mechanisch stabilen Komponenten ist- in erster Linie Binde- und Narbengewebe -, desto stabiler ist ein Plaque.
2. Die lytischen Enzyme eines Entzündungsinfiltrates schädigen die Struktur eines Plaque und Schwäche damit dessen fibröse Kappe, die das Plaque "abdeckt", was zur Schädigung des Plaques führt.
3. Kalk kann sich in der fibrösen Kappe so absetzen, dass sich ein scharfes, Messerklingen artiges Gebilde ergibt, dessen scharfe Kante bei den wellenartigen Bewegungen der Gefässwand die fibröse Kappe eines Plaque einschneiden kann, und Letztere so dermassen schwächt, dass es zur Ablösung des Plaques kommen kann.
|

Beurteilen Sie der Verweis!
|
Die Instabilität des Plaques wird außerdem noch vom schnelleren Blutfluss am eingeengten Gefässlumen beeinflusst, der einen erniedrigten intraluminaren Druck mit sich bringt (Bernoulli - Gesetz) (KV_I_2_2_Verweis); dies wirkt als eine Art Sog auf den "Rücken", bzw. die fibröse Kappe des Plaques. Prä- und poststenotisch ergibt sich die genau gegenteilige Situation, der Blutstrom verlangsamt sich und der intraluminale Druck ist erhöht, die peristenotischen Gefässwandabschnitte werden daher nach aussen gedrückt. Zu dem muss auch noch der Mobilitätsunterschied zwischen den verhärteten Gefässabschnitten und den benachbarten, noch mobilen Gefässwandabschnitten (siehe Windkesselfunktion der Gefässe), zu den Risikofaktoren einer Plaqueschädigung gezählt werden. All dies trägt dazu bei, dass es vor allem am Randgebiet solch einer Veränderung, durch die mechanische Belastung zu Schädigungen, Rissen, Einblutungen, oder gar zur Spaltung der Gefässwand (Dissektion) kommen kann.
I./2.3.7.2.8.: Ausweichmöglichkeiten der Organe bei sklerotischen Gefässen
Bildet sich eine sklerotische Gefässverengung langsam und stetig aus, so bekommt das betroffene Organ Zeit dazu, bestimmte Alternativen zum Überleben der Gewebe auszubilden, also einen Verlust von Organgewebe (Infarkt) zu umgehen - i.A. müssen hier solche Kompromisse, wie die Ausbildung einer chronisch ischämischen interstitiellen Fibrose. Die betroffenen Gewebe lernen es, mit hypoxischen Zuständen dadurch umzugehen, dass sich die versorgenden Gefäße häufiger verbinden (anastomosieren), bzw. bereits vorhandene Kollateralen verstärkt werden.
Die Theorie der Glagov-schen, sog. kompensatorischen Gefässerweiterungen besagt, dass sich gleichzeitig mit der Plaquebildung auch die Gefäßwand erweitert, ihr Durchmesser also größer wird; die lumenverengende Wirkung eines Plaque kann also solange kompensiert werden, bis über 40 % des Gefässlumens durch das Plaques verstopft sind; so bildet sich bis zu diesem Punkt eigentlich keine Lumenveränderung aus. Diese Angaben korrelieren mit der Tatsache, dass man bis zu einer 50%-igen Verengung eines Gefässlumens von einer nur leichten Stenose redet Bei extremem Hungern und bei Körpergewichtsverlust werden die fettreichen Plaques verkleinert.
I./2.3.7.2.9.: Klinische Erscheinungsformen der Arteriosklerose
|
 |
Die Folge einer Gefässverhärtung, die von klinischer Bedeutung ist, ist die mit der verminderten Blutversorgung einhergehende Funktionsstörung eines Gewebes. Es kann zu ischämischen Herzbeschwerden (angina pectoris), Herzinfarkten, Störungen der Hirndurchblutung oder zu Hirninfarkten kommen. Sind die Gefäße des Darmes befallen, kann es vorkommen, dass 10 bis 15 Minuten nach dem Essen ischämisch bedingte Darmschmerzen (angina abdominalis) auftreten, bzw. auch schon erosiv ulzerative Veränderungen im Darm als Zeichen einer ischämischen Colitis zu sehen sind. Kommt es zu einem totalen Stop der Blutversorgung (z.B. durch eine mesenteriale Thrombose), kann es zu einem Darminfarkt kommen. Ein weiteres Beispiel für ischämische Schmerzen sind die der unteren Extremität, bei dem es zu einem zeitweiligen Stop der Blutversorgung kommt, der solche Schmerzen verursacht, dass der Betroffene stehen bleiben muss; es bildet sich also die Claudicatio intermittens (Schmerzen des Schenkels- und/oder Unterschenkels beim Gehen, die den Patienten dazu zwingen, stehen zu bleiben).
|
 |
Schliesst sich ein arterieller Ast der unteren Extremität so sehr, dass er Letztere nicht mehr mit genügend Blut versorgen kann, kommt es zu einem Gangrän. Eine spezielle Form hiervon ist das Leriche-Syndrom: die Verengung des aorto-iliakalen Gefässabschnittes und eine gleichzeitige Impotenz. Sind die Arterien der Nieren befallen, kommt es zu einer renovaskulären Arteriosklerose, und zur Bildung einer sekundären Hypertonie. Dort, wo sich Gefässverengungen befinden (z.B. Abzweigung der A.carotis), kann man die sich bildenden Turbulenzen durch Geräusche beim Abhören detektieren. Distal der Gefässverengung ist der Puls abgeschwächt.
I./2.3.7.2.10.: Eine besondere und seltene Form der Gefässverhärtung: die Mönckeberg - Mediasklerose
Diese Gefässveränderung bildet sich in der Media von mittelgrossen Arterien der unteren Extremität und zeigt eine diffuse oder fokale Verkalkungen Letzterer. Es sind vor allem über 50-jährige betroffen, die an Diabetes mellitus erkrankt sind. Die Erkrankung kann röntgenologisch durch die Verkalkungen aufgezeigt werden.
|
|